Proteinkinazės
Baltymų fosforilinimo reakcijas katalizuojantys fermentai (EC 3.7.1.39). Visos polinės signalinės molekulės, veikiančios ląsteles taikinius pro membranų receptorius, savo biologines funkcijas atlieka, fosforilindamos specialius baltymus ir fermentus, reguliuojančius ląstelių metabolizmą. Fosforilinimo metu keičiasi jų aktyvumas – didėja arba mažėja. Baltymų fosforilinimą katalizuoja proteinkinazės, fosforilindamos seriną, treoniną ar tiroziną. Proteinkinazės gali būti membraninio receptoriaus subvienetas, pvz., insulino receptoriaus tirozino proteinkinazė. Kita proteinkinazių grupė veikia per antrinius tarpininkus (cAMP, cGMP, Ca2+, DAG).
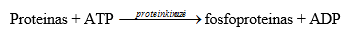
Proteinkinazė A (cAMP- skatinanti) dalyvauja perduodant adenilatciklazinės sistemos signalą. Proteinkinazė A sudaryta iš 4 subvienetų R2C2 – dviejų reguliacinių (R2) ir dviejų katalizinių (C2). R2C2 kompleksas nepasižymi fermentiniu akyvumu. Daugelyje audinių proteinkinazė A sujungta su „inkariniais baltymais“ (angl. Camp – dependent protein kinase anchoring protein) AKAPs yra sujungimo centrai su reguliaciniu proteinkinazės subvienetu. Per AKAPs proteinkinazė A susijungia su membrana, čia yra cAMP sudarantys fermentai (adenilatciklazės) arba jos hidrolazė (fosfodiesterazė), taip pat baltymų, kurių aktyvumą reguliuojant dalyvauja nuo potencialo priklausomi Ca2+ kanalai. Proteinkinazės A reguliaciniuose subvienetuose yra specialūs cAMP prijungimo centrai. cAMP prisijungus prie reguliacinių subvienetų, įvyksta jų konformacinai pokyčiai ir sumažėja giminingumas kataliziniams subvienetams C. Įvyksta disociacija:
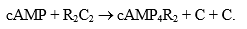
C subvienetai ir yra proteinkinazės A aktyvi forma, kuri katalizuoja baltymo fosforilinimą prie serino ir treonino. Įvairūs proteinkinazių A kataliziniai subvienetai C nėra tapatūs, jie skiriasi pirmiausia baltymų–substratų specifiškumu.
Proteinkinazė C dalyvauja inozitolfosfatinėje signalo perdavimo sistemoje. Fermentas sudarytas iš dviejų funkcionaliai skirtingų domenų – reguliacinio ir katalizinio. Padidėjusi citozolyje kalcio koncentracija padidina proteinkinazės C giminingumą membranos fosfatidilserinui. Proteinkinazės C persikėlimas (translokacija) prie membranos padeda fermentui prisijungti prie DPG, kuris dar padidina proteinkinazės C giminingumą Ca2+. Katalizinis domenas turi ATP ir baltymo-substrato prijungimo centrą. Aktyvi proteinkinazė C baltymą fosforilina per seriną ir treoniną. Ląstelėje sumažėjusi kalcio jonų koncentracija pažeidžia proteinkinazės C ryšį su fosfatidilserinu ir diacilgliceroliu. Fermentas tampa neaktyvus ir atsiskiria nuo membranos.
Proteinkinazės G, skirtingai nuo proteinkinazės A, yra ne visuose audiniuose. Jos randama plaučiuose, lygiuosiuose raumenyse, trombocituose ir smegenėlėse. Jos izoformos gali būti sujungtos su membranomis arba būti citozolyje. Tirpi proteinkinazė G sudaryta iš dviejų tapačių subvienetų, iš kurių kiekvienas turi du cGMP prijungimo centrus. Prisijungus cGMP prie reguliacinio centro, įvyksta subvieneto konformaciniai pokyčiai ir padidėja fermento katalizinis aktyvumas. Kaip ir proteinkinazės A ir C, proteinkinazė G yra specifinė substratams, kuriuos ji fosforilina per seriną ir treoniną.
Šaltinis | Dažniausiai vartojamų biomedicinos terminų ir sąvokų aiškinamasis žinynas | Lietuvos sveikatos mokslų universitetas | Akademikas Profesorius Antanas Praškevičius, Profesorė Laima Ivanovienė

