Vaistų poveikis skydliaukės veiklai
Įvadas
Sąrašas vaistų, kurie neigiamai veikia skydliaukės funkciją ar iškreipia standartinius skydliaukės tyrimų rezultatus, sparčiai didėja. Didžioji dalis skydliaukei kenkiančių vaistų yra dažnai naudojami preparatai, pavyzdžiui, nereceptiniai vaistai, pažangioji medicinos terapija, vaistai nuo aritmijos, navikų, gliukokortikoidai. Farmakologiniai skydliaukės gydymo padariniai gali būti labai skirtingi – nuo laboratoriniuose tyrimuose pasitaikančių artefaktų iki sunkaus skydliaukės funkcijos sutrikimo (1).
Skydliaukės hormonų fiziologija
Norint išsiaiškinti, kokį poveikį skydliaukės veiklai daro vaistai, reikia suprasti skydliaukės hormonų fiziologiją. Skydliaukės hormonų sintezę ir sekreciją reguliuoja tirotropinis hormonas. Tirotropinio hormono sekreciją skatina tirotropiną atpalaiduojantis hormonas, o išsiskyrimą slopina skydliaukės hormonai, veikdami neigiamojo grįžtamojo ryšio principu. Su maistu gaunamas jodidas (jodo jonas), aktyvios pernašos būdu per membranoje esantį natrio ir jodido baltymą, yra transportuojamas į skydliaukės folikulines ląsteles, tuomet jodidas iš folikulinių ląstelių, per anijonus nešantį baltymą pendriną, difunduoja į folikulo spindį (2, 3). Folikulo spindyje, veikiamas skydliaukės peroksidazės, jodidas oksiduojamas ir jungiamas prie specifinių tirozino radikalų, esančių tiroglobulino molekulėje. Tiroglobulino molekulėse esančios joduotos tirozino grupės yra sujungiamos ir sintetinamas tiroksinas (T4) arba trijodtironinas (T3). Folikulų ląstelės reaguoja į padidėjusį tirotropino kiekį, formuoja pinocitozės pūsleles, užpildytas spindyje esančio koloido, pūslelės jungiasi su folikulinėse ląstelėse esančiomis lizosomomis ir taip iš tiroglobulino atpalaiduojami T4 ir T3. Specialių nešiklių padedami atpalaiduoti skydliaukės hormonai pernešami į sisteminę kraujotaką (1, 2).
Tiroksinas yra hormonas, 100 proc. sintetinamas skydliaukėje, o aktyvaus skydliaukės hormono trijodtironino 80 proc. sintetinamas iš tiroksino apykaitos produktų kepenyse ir inkstuose. Daugiau nei 99 proc. cirkuliuojančių T4 ir T3 prisijungia prie serumo baltymų, tokių kaip tiroksiną jungiantis globulinas, transtiretinas ir albuminas. Skydliaukės hormonai į audinius patenka per monokarboksilato nešiklius ir organinius anijonus pernešančius polipeptidus. Branduolyje, prisijungdamas prie skydliaukės hormonų receptorių, T3 kontroliuoja genų ekspresiją (2).
Skydliaukės hormonų metabolizmas prasideda nuo jodo atomų pašalinimo kepenyse, skydliaukėje, inkstuose, odoje ir placentoje. Skydliaukės hormonai gali būti metabolizuojami gliukuronidacijos ar sulfacijos būdu. Skydliaukės hormonų rezervuaras suformuojamas gliukuronidacijos metu, kai tulžyje esantys gliukuroniduoti skydliaukės hormonai, veikiami žarnyno bakterijų, išardomi ir perdirbami enterohepatinės cirkuliacijos metu (4). Sulfacijos metu, veikiant specialiems fermentams, yra palengvinamas jodo atomų pašalinimas. Nuo skydliaukėje susidariusių tarpinių jodo produktų (monojodtirozino, dijodtirozino, kt.), veikiant tam tikram dehalogenazės fermentui, pašalinami jodo atomai ir taip išsaugomas jodas vėlesnei skydliaukės hormonų sintezei (1).
Vaistų, veikiančių skydliaukės funkcijas, klasifikacija
Skydliaukės hormonų kontrolė, išskyrimas, sintezė, pernešimas ir metabolizmas yra jautrūs vaistų poveikiui (1 pav.). Keli vaistai ar vaistų klasės, tokie kaip amiodaronas, gliukokortikoidai ir vaistai nuo epilepsijos, gali sukelti įvairius skydliaukės veiklos sutrikimus. Pacientai, kuriems taikoma pakaitinė skydliaukės hormonų terapija, jautriai reaguoja į skirtingų vaistų sąveiką, dėl kurios kinta vaistų ištirpimas, absorbcija virškinimo trakte ir metabolinis klirensas (1).
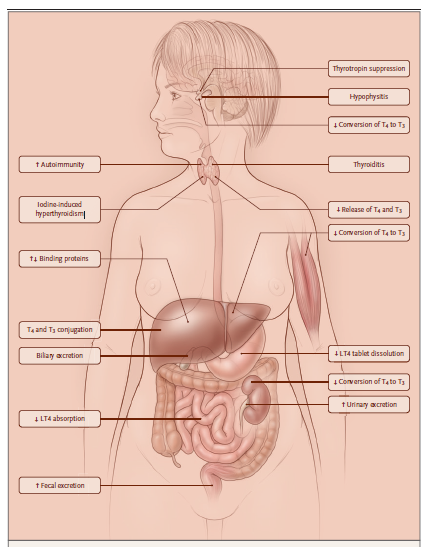
1 pav. Anatominės vaistų ir skydliaukės funkcijos sąveikos vietos (1)
Vertimas
Thyrotropin suppression – Tirotropino slopinimas
Hypophysitis – Hipofizės uždegimas
Conversion of T4 to T3 - ↓T4 pavertimą į T3
Autoimmunity - ↑Autoimunitetas
Thyroiditis – Skydliaukės uždegimas
Iodine-induced hyperthyroidism – Jodo sukeltas hipertiroidizmas
Release of T4 and T3- ↓T4 ir T3 išleidimas / atpalaidavimas;
Binding proteins – ↓↑Jungiančių baltymų
T4 and T3 conjugation - T4 ir T3 sujungimas
Biliary excretion – Pašalinimas su tulžimi
LT4 tablet dissolution - ↓LT4 tabletės ištirpimas
LT4 Absorption - ↓LT4 absorbcija (pasisavinimas)
Urinary excretion - ↑Pašalinimas su šlapimu
Fecal excretion - ↑Pašalinimas su išmatomis
Conversion of T4 to T3 - ↓T4 pavertimą į T3
Nustatyta daugybė įvairių vaistų ir skydliaukės sąveikos vietų, įskaitant centrinę pogumburio ir hipofizės kontrolę, tiesioginį poveikį skydliaukės hormonų sintezei, destruktyvaus tiroidito pradžią, baltymų prisijungimo ar tiekimo į tikslinius audinius trukdymą ir aktyvinimo trukdymą bei skydliaukės hormonų dispoziciją. Pacientams, vartojantiems egzogeninius skydliaukės hormonus, pasireiškia specifinė vaistų sąveika: tablečių tirpimo slopinimas ir levotiroksino malabsorbcija (sutrikęs pasisavinimas). LT4 žymi levotiroksiną.
Vaistai, veikiantys pogumburio ir hipofizės funkcijas
Centrinis hipotiroidizmas (hipotirozė) pasireiškia 40–70 proc. sintetiniu retinoidu – beksarotenu, kuris sukelia greitą ir gilų tirotropinio hormono slopinimą, gydytų pacientų. Normali skydliaukės funkcija atsikuria per kelias savaites po gydymo nutraukimo (5, 6). Šie pokyčiai atsiranda dėl tiesioginio beksaroteno poveikio hipofizės tirotrofams ir sustiprėja dėl padidėjusio skydliaukės hormonų metabolizmo (7).
Hipotiroidizmas pasireiškia ir daugeliui dėl antinksčių žievės karcinomos mitotanu gydytų pacientų (8, 9). Atlikus tyrimus ir pastebėjus neįprastą laisvojo T4 kiekį, netinkamai normalų tirotropino kiekį ir susilpnėjusį tirotropino atsaką į tirotropiną atpalaiduojantį hormoną, galima įtarti centrinį hipotiroidizmą (8). Laisvojo T4 kiekis pradeda mažėti per pirmuosius 3 mėnesius nuo gydymo mitotanu pradžios. Pacientams dažnai reikalinga ilgalaikė pakaitinė skydliaukės hormonų terapija (9).
Imuninės sistemos patikros taškų inhibitoriai, kurie slopina citotoksinį T limfocitų antigeną 4 (CTLA-4), ir užprogramuotos ląstelių mirties (angl. programmed death-1 – PD-1) receptoriai gali turėti neigiamą poveikį endokrininės sistemos veiklai. Hipofizės uždegimas (reta liga, galinti sukelti hipopituitarizmą) dažniau pasireiškia pacientams, vartojantiems CTLA-4 inhibitorius, o vartojant PD-1 inhibitorius dažniau pasireiškia pirminė skydliaukės disfunkcija (10). Ipilimumabas, preparatas, veikiantis CTLA-4, yra susijęs su destruktyviu hipofizės uždegimu, antinksčių nepakankamumu, hipogonadizmu ir įvairaus laipsnio centriniu hipotiroidzimu, pasireiškiančiu 3–10 proc. nuo melanomos gydytų pacientų (3 mg/1 kg kūno svorio kas 3 savaites iki 4 ciklų). Poveikis pasireiškia per pirmus 3 mėnesius nuo gydymo pradžios (per 2–4 ciklus). Pacientai gali skųstis galvos skausmu, šalčio netoleravimu, nuovargiu, svorio mažėjimu ar libido praradimu. Atlikus magnetinio rezonanso tyrimą, pastebimas hipofizės išsiplėtimas, hipofizės kotelio sustorėjimas ir homogeninis kontrastinės medžiagos kaupimas (11–13). Lytinių liaukų ir skydliaukės funkcijos atsikuria beveik pusei pacientų, o antinksčių veikla retai kada normalizuojasi (10, 11).
Kelios vaistų grupės, tokios kaip gliukokortikoidai, dopamino agonistai, somatostatino analogai ir metforminas, slopina tirotropino išsiskyrimą, tačiau nesukelia reikšmingų pakitimų cirkuliuojančiam T4 kiekiui (14, 15). Pacientams, vartojantiems šiuos vaistus, tirotropino slopinimas nėra metaboliškai reikšmingas, tačiau mažas tirotropino lygis ir normalus laisvojo T4 kiekis gali suklaidinti. Tuomet, įtariant subklinikinį hipertiroidizmą, atliekami nereikalingi tyrimai, paskiriamas netinkamas ir nebūtinas gydymas (1).
Vaistai, veikiantys skydliaukės hormonų sintezę ir išskyrimą
Jodo koncentracijai skydliaukėje pasiekus kritinį lygį, vyksta praeinantis skydliaukės hormonų gamybos sumažėjimas (Wolffo-Chaikoffo efektas). Tikslus mechanizmas nėra žinomas, tačiau, skydliaukėje kaupiantis jodo junginiams, gali pasireikšti ūminis skydliaukės peroksidazės sumažėjimas (16). Asmenys, kurių skydliaukės veikla nesutrikusi, nuo šio efekto sukeltų padarinių išgyja per 1–2 savaites, o asmenys, kurių skydliaukės funkcija yra sutrikusi dėl skydliaukės audinio praradimo (operacijos ar radioaktyviojo jodo terapijos metu) ar limfocitinio tiroidito, gali šio efekto sukelto poveikio neatsikratyti, kol nebus pašalintas visas jodo perteklius. Per didelis jodo kiekis gali prisidėti prie tirotoksikozės išsivystymo (Jodo-Basedowo reiškinys), ypač pacientams, kurių skydliaukė funkcionuoja nepriklausomai nuo tirotropinio hormono (autonominis valdymas) (17).
Dažniausi per dideliu jodo kiekiu pasižymintys preparatai: kontrastinės medžiagos, naudojamos atliekant kompiuterinę tomografiją, tulžies pūslės rentgenogramą; amiodaronas, vietinio veikimo povidono jodas, nereceptiniai vaistai; papildai (atsikosėjimą lengvinantys, makštį drėkinantys ir jūros dumblių preparatai). Trečios kartos vaistą nuo aritmijos, amiodaroną, sudaro 37,3 proc. jodo, kuris yra metabolizuojamas iš dalies pašalinant jodo atomus. Suvartojus 200 mg tabletę, 7 mg jodido yra atpalaiduojami, todėl susidaro 45 kartus didesnė jodo koncentracija, nei rekomenduojama paros norma (150 μg vyrams ir ne nėščioms moterims) (18). Amiodaronas gali sukelti hipotirozę jautriems pacientams, dėl jodo, esančio šiame preparate, gali išsivystyti hipertiroidizmas, kitaip vadinamas pirmojo tipo amiodarono sukelta tirotoksikoze (17).
Vartojant ličio preparatus, gali padidėti skydliaukė ar išsivystyti hipotiroidizmas, nes yra slopinama pinocitozė ir taip sumažinamas skydliaukės hormonų išskyrimas. Tyrime, kuriame dalyvavo pacientai, sergantys maniakine depresija (bipolinis afektinis sutrikimas), atlikus ultragarsinį skydliaukės įvertinimą, buvo nustatytas nenormalus skydliaukės padidėjimas 50 proc. ličio preparatais gydytų pacientų (19). Hipotiroidizmo paplitimas tarp pacientų, vartojančių ličio preparatus, labai skiriasi. Iš 1 778 paviešintų atvejų pastebėtas vidutinis paplitimas buvo 17,6 proc. (20). Atlikus metaanalizę pastebėta, kad hipotiroidizmo paplitimas tarp pacientų, gydytų ličio preparatais, padidėjo 6 kartus, palyginti su paplitimu tarp kontrolinių grupių (21). Moteriškoji lytis ir vyresnis nei 40 metų amžius yra rizikos veiksniai, sietini su lėtiniu limfocitiniu tiroiditu (Hašimoto tiroiditas), teigiamu skydliaukės peroksidazės antikūnų testu ir galimu polinkiu į sumažėjusį skydliaukės hormonų rezervą bei padidėjusią autoimuninio sutrikimo riziką (22). Ličio vartojimas yra susijęs ir su neskausmingu skydliaukės uždegimu. Nors nežinomas tikslus mechanizmas, tačiau maždaug pusei pacientų skydliaukės antikūnų testai yra teigiami (23).
Vaistai, sukeliantys autoimuninius skydliaukės sutrikimus
Naujesni vaistai, kurie skatina imuninės sistemos kovą su vėžinėmis ląstelėmis, didina ir autoimuninių sutrikimų riziką. Įvairiuose literatūros šaltiniuose pastebima, kad pirminis skydliaukės funkcijos sutrikimas išsivysto 5–10 proc. CTLA-4 inhibitoriais gydytų pacientų, 10–20 proc. pacientų, gydytų PD-1 inhibitoriais, ir daugiau kaip 20 proc. pacientų, gydytų vaistų deriniu (24–31). Dauguma šiais preparatais nuo vėžio gydomų pacientų serga neskausmingu tiroiditu, kuris pasireiškia trumpalaike tirotoksikoze, po kurios išsivysto hipotiroidizmas. Paprastai tirotoksikozė išsivysto praėjus 4–8 savaitėms nuo gydymo pradžios, tačiau ji gali pasireikšti ir per pirmąsias 2 savaites, kai taikoma ssudėtinė terapija, arba per 18 savaičių, kai taikoma terapija nuo CTLA-4 (27, 29). Tirotoksikozės etapas dažnai būna lengvas ir gali būti nepastebėtas, praeina per 3–10 savaičių, tačiau buvo nustatyta ir vidutiniškai sunkių bei sunkių šio etapo atvejų (27, 30). Hipotirozė pasireiškia praėjus 10–20 savaičių nuo gydymo pradžios ir dažnai būna negrįžtama (10, 31). Imuninės sistemos patikros taškų blokavimo terapija nėra nutraukiama dėl nepageidaujamo skydliaukės poveikio, kurį galima suvaldyti (17, 27, 32).
Skydliaukės funkcijos suprastėjimas vartojant imuninės sistemos patikros taškus blokuojančius preparatus yra susijęs su imuninės tolerancijos sumažėjimu (11, 33). Sutrikus skydliaukės veiklai, 40–50 proc. pacientų nustatoma antikūnų prieš skydliaukės peroksidazę ar tiroglobuliną, tačiau jų patofiziologinis vaidmuo nėra aiškus (28, 31). Daugeliu atvejų išankstinis gydymas nėra skiriamas. Kai kurie tyrimai rodo, kad imuninės sistemos patikros taškų blokavimo metu padidėja esamų antikūnų kiekis ar sintetinami nauji antikūnai (34–36). Teigiamas antikūnų testas, atliktas prieš gydymą, rodo padidėjusią vaistų sukelto skydliaukės funkcijos sutrikimo riziką (34, 36). Reikia atlikti papildomus tyrimus, norint suprasti neigiamą imuninės sistemos patikros taškų blokavimo poveikį skydliaukės veiklai (1).
Nespecifinius imuninę sistemą stimuliuojančius citokinus, tokius kaip interleukinas-2 ir interferonas alfa, vartojantiems pacientams, sergantiems išplitusia inkstų ląstelių karcinoma, melanoma ar hepatitu C, pasireiškė skydliaukės funkcijos sutrikimai (15–50 proc. pacientų), tokie kaip tiroidito sukelta trumpalaikė tirotoksikozė, po kurios išsivysto hipotiroidizmas (37–39). Iš 89 pacientų, sergančių solidiniais navikais ir gydytų interleukinu-2, 22 proc. pacientų išsivystė skydliaukės funkcijos sutrikimas, kuris pasireiškė lengva tirotoksikoze per pirmąsias 7 savaites ir vėlesne hipotireoze, kuri pasireiškė per 11 savaičių nuo gydymo pradžios (39). Iš 1 233 pacientų, sergančių hepatitu C, kurių skydliaukės veikla prieš vartojant interferoną alfą buvo normali, 16,7 proc. pacientų pasireiškė skydliaukės sutrikimai, iš jų maždaug 5 proc. sirgo tirotoksikoze ir 12 proc. hipotiroze (38). Citokinų sukeltas skydliaukės funkcijos sutrikimų mechanizmas yra mažai žinomas, tačiau yra neproporcingai didelė skydliaukės autoimuninio sutrikimo rizika pacientams, kuriems būdingi šie rizikos veiksniai: moteriškoji lytis, teigiamas skydliaukės antikūnų testas gydymo pradžioje ar gydymo metu, beveik normalus pradinis tirotropino lygis (1).
Alemtuzumabas – žmogaus monokloninis antikūnas, nukreiptas prieš CD52 ląstelių paviršiaus antigeną. Pacientams, sergantiems išsėtine skleroze, gydymas alemtuzumabu sukelia cirkuliuojančių B ląstelių ir T ląstelių sumažėjimą, padidina skydliaukės autoimuninio sutrikimo riziką (40, 41). Iš 248 pacientų, gydytų alemtuzumabu, skydliaukės funkcijos sutrikimai išsivystė 41,1 proc., o Graveso liga išsivystė 71,6 proc. preparatą vartojusių pacientų (vidutinis intervalas tarp paskutinės alemtuzumabo dozės ir Graveso ligos pradžios buvo 17 mėnesių) (41). Po alemtuzumabo vartojimo dažniau pasireiškia poūmis skydliaukės uždegimas ir pirminis hipotiroidizmas (40). Dauguma su alemtuzumabu susijusių skydliaukės funkcijos sutrikimų diagnozuojami per 3 metus nuo gydymo nutraukimo, tačiau yra atvejų, kai jie nustatomi po gydymo praėjus 5–9 metams (40, 41). Graveso liga sergantiems pacientams po gydymo alemtuzumabu pasireiškia dideli antikūnų prieš tirotropino receptorius stimuliavimo ir blokavimo svyravimai (nedažnas reiškinys, pasireiškiantis besikeičiančiais hipertiroidizmo ir hipotirozės periodais) (41).
Atliekant antros fazės klinikinius alemtuzumabo tyrimus, 15,1 proc. išsėtine skleroze sergančių pacientų, kuriems išsivystė skydliaukės funkcijos sutrikimas, nustatyti teigiami skydliaukės peroksidazės antikūnų testai, o 54,8 proc. pacientų testai buvo neigiami gydymo pradžioje, tačiau gydomuoju laikotarpiu tapo teigiami (40). Pastebima, kad alemtuzumabo vartojimas pacientams, sergantiems leukemija ar reumatoidiniu artritu, nebuvo susijęs su Graveso liga, o imunoterapijos, interferono beta-1a vartojimas pacientams, sergantiems išsėtine skleroze, sukelia nedidelio laipsnio skydliaukės funkcijos sutrikimą (6,5 proc.) (40, 42, 43).
Nėra tiksliai žinoma, kaip po alemtuzumabo vartojimo išsivysto skydliaukės autoimuniniai sutrikimai. Vienoje teorijų, susijusių su limfocitų atkūrimu po gydymo alemtuzumabu, nurodoma, kad ankstyvas B ląstelių atsikūrimas organizme dar prieš reguliuojančių T ląstelių atsinaujinimą leidžia sustiprinti B ląstelių sukeliamus autoimuninius sutrikimus (44). Kiti skydliaukės autoimuninių sutrikimų po imuninės sistemos atsikūrimo pavyzdžiai yra Graveso liga, išsivysčiusi po labai aktyvaus, išplitusio žmogaus imunodeficito viruso infekcijos, gydymo antiretrovirusiniais vaistais, taip pat skydliaukės autoimuniniai sutrikimai pasireiškia pacientams, kuriems buvo išgydyta endogeninė Cushingo liga, bei moterims po gimdymo (45).
Vaistai, sukeliantys tiesioginius skydliaukės pažeidimus
Amiodaronas sukelia destruktyvųjį tiroiditą, kitaip vadinamą amiodarono sukelta antrojo tipo tirotoksikoze, kuri pasireiškia 5–10 proc. šiuo preparatu gydytų pacientų. Manoma, kad šį sutrikimą sukelia tiesioginis citotoksinis amiodarono poveikis tirocitams (17). Pacientai, vartoję šį preparatą, gali patirti nuolatinę tachikardiją ar pastebėti pablogėjusią aritmiją, nejausti diskomforto atliekant fizinį skydliaukės patikrinimą. Pacientams, vartojusiems amiodaroną, atlikus tyrimus, pastebimas padidėjęs T4 ir T3 kiekis kraujo serume bei sumažėjęs tirotropino kiekis serume. Pirmojo tipo amiodarono sukelta tirotoksikozė gydoma antitiroidiniais preparatais, o antrojo tipo liga pirmiausia gydoma gliukokortikoidais (46). Praktikoje dažnai sunku atskirti pirmojo tipo tirotoksikozę nuo antrojo tipo tirotoksikozės, o skubus gydymo poreikis pacientams, turintiems silpną širdį, verčia gydytojus skirti pradinį gydymą tiek antitiroidiniais vaistais, tiek gliukokortikoidais (17, 47).
Tikslinė vėžio terapija, kai yra naudojami tirozino kinazės ir multikinazės inhibitoriai, yra susijusi su padidėjusia tiroidito rizika (48). Dažniausiai pokyčiai pastebimi tirozino kinazės inhibitorius dėl išplitusios inkstų ląstelių karcinomos ar virškinimo trakto stromos navikų vartojantiems pacientams (48, 49). Atlikus 3 didelius klinikinius tyrimus pastebėta, kad hipotireozė pasireiškė 14–25 proc. pacientų, sirgusių inkstų ląstelių karcinoma ir gydytų sunitinibu (50–52). Dauguma atvejų buvo įvertinti kaip lengvi ar vidutinio sunkumo, tačiau retais atvejais pasireiškė sunki skydliaukės disfunkcija. Tyrime, kuriame dalyvavo 42 pacientai, nustatyta, kad 36 proc. dalyvių, kurių skydliaukės funkcija prieš vartojant sunitinibą buvo normali, pasireiškė hipotiroidizmas (daugelio tirotropino kiekis buvo didesnis nei 20 mTV/l (49). Manoma, kad ilgėjant gydymo terapijai didėja hipotiroidizmo išsivystymo tikimybė. Destruktyvusis tiroiditas, pasireiškiantis trumpalaike tirotoksikoze, po kurios išsivysto hipotirozė, buvo nustatytas 40 proc. pacientų. Tiroidito išsivystymo mechanizmas tirozino kinazės inhibitorius vartojantiems pacientams gali būti susijęs su išemija, išsivystančia dėl kelių šios klasės vaistų gebėjimo slopinti kraujagyslių endotelio augimo faktoriaus receptorius (48). Kai kuriems pacientams, atliekus ultragarsinį tyrimą, nustatomas skydliaukės sumažėjimas (49).
Vaistai, veikiantys skydliaukės hormonus surišančius baltymus
Tokie vaistai, kaip geriamasis estrogenas, selektyvusis estrogeno receptorių moduliatorius, metadonas, heroinas, mitotanas ir fluorouracilas, padidina tiroksiną jungiančio globulino kiekį. Vartojant androgenus, gliukokortikoidus ir niaciną, šio baltymo kiekis sumažėja. Pacientams, kuriems taikoma pakaitinė skydliaukės hormonų terapija, vartojant estrogeno turinčius vaistus pastebimi kliniškai reikšmingi tiroksiną jungiančio globulino pokyčiai (53). Tokiems pacientams padidėjęs hormonus jungiančio baltymo lygis lemia papildomą T4 surišimą net ir tada, kai laisvojo T4 lygis yra mažas. Taigi pacientams, vartojantiems skydliaukės hormonų preparatus, pradžioje reikės didesnės dozės geriamojo estrogeno, o pacientams, kurių skydliaukės funkcija nesutrikusi, padidės endogeninių skydliaukės hormonų gamyba. Transderminis estradiolis turi minimalų poveikį tiroksiną jungiančiam globulinui, nes jį vartojant išvengiama vaisto metabolizmo kepenyse (54).
Vartojant vaistus nuo epilepsijos (fenitoinas, karbamazepinas), salsalatą, nesteroidinius vaistus nuo uždegimo, dideles dozes furozemido ir heparino, vyksta vaistų sukeltas skydliaukės hormonų išstūmimas iš hormonus jungiančių baltymų. Dažniausiai ši vaistų sąveika yra kliniškai nereikšminga, o vartojant vaistus nuo epilepsijos bei hepariną pirmiausiai pastebimi pokyčiai skydliaukės funkcijos laboratoriniuose tyrimuose (1).
Vaistai, veikiantys skydliaukės hormonų aktyvinimą, metabolizmą ir šalinimą
Amiodaronas, deksametazonas, didelėmis dozėmis vartojamas propranololis, cholecistografiniai preparatai (ipodatas, jopano rūgštis), propiltiouracilas slopina T4 pavertimą į T3. Amiodaronas slopina T3 susidarymą hipofizėje bei periferijoje. Deksametazono gebėjimas slopinti T4 pavertimą į T3 yra panaudojamas gydant pacientus, sergančius sunkia tirotoksikoze [55]. Propranololio vartojimas įprastinėmis dozėmis yra kliniškai nereikšmingas (1).
Gydant vaistais (fenobarbitalis, fenitoinas, karbamazepinas, rifampinas), kurie aktyvina gliukuronidacijos fermentus, kartais būtina padidinti levotiroksino dozę (56, 57). Tirozino kinazės inhibitoriai taip pat padidina skydliaukės hormonų metabolizmą. Klinikiniuose tyrimuose pacientams, sergantiems skydliaukės vėžiu bei vartojantiems levotiroksiną, buvo skirtas sorafenibas. Pastebėta, kad praėjus 26 savaitėms nuo gydymo pradžios pagreitėjo levotiroksino inaktyvinimas (58).
Tulžies rūgščių sekvestrantai (cholestiraminas, kolestipolis, kolesevelamas) sumažina skydliaukės hormonų kiekį, trukdydami jų perdirbimui enterohepatinės cirkuliacijos metu sergant tiek endogenine, tiek jatrogenine tirotoksikoze (59, 60).
Vaistai, veikiantys skydliaukės hormonų preparatų absorbciją
Geriant hormonines tabletes, jas reikia ištirpinti rūgštinėje aplinkoje, kad patekusios į plonąją žarną jos geriau absorbuotųsi (61,62). Vartojant levotiroksino tabletes nevalgius, maždaug 60–80 proc. preparato yra absorbuojama per 2–4 val. (63). Kasdien vartojant protonų siurblio inhibitorius padidėja levotiroksino poreikis, kuris tenkinamas padidinant levotiroksino dozę arba pereinant prie skysto preparato (63–65).
Vaistai, trukdantys skydliaukės hormonų absorbcijai virškinimo trakte, yra geležies sulfatas, kalcio karbonatas, aliuminio hidroksidas, sukralfatas, tulžies rūgščių sekvestrantai ir raloksifenas. Rekomenduojama vartoti skydliaukės hormoną 4 val. prieš bet kurio iš šių vaistų vartojimą arba levotiroksiną vartoti prieš miegą (32). Patariama vaistus vartoti nevalgius, nes net sojų mišinys, pienas ar kava gali sutrikdyti vaisto absorbciją (62). Reikėtų informuoti pacientus, kad, pradėjus vartoti šiuos vaistus ar nutraukus jų vartojimą, pakis skydliaukės hormonų koncentracija, todėl reikės atlikti pakartotinius skydliaukės hormonų tyrimus (1).
Vaistai, iškraipantys skydliaukės tyrimo rezultatus pacientams, kurių skydliaukės veikla nesutrikusi
Yra keletas vaistų, galinčių iškraipyti skydliaukės laboratorinių tyrimų rezultatus pacientams, kurių skydliaukės veikla nesutrikusi. Mokėjimas atskirti vaistų sukeltus pakitimus nuo tikrojo skydliaukės funkcijos sutrikimo gali padėti išvengti nereikalingų diagnostinių ar terapinių intervencijų (1).
Biotinas
Biotinas yra vartojamas nervų ir raumenų sutrikimams gydyti, tokiems kaip išsėtinė sklerozė, taip pat yra populiarus maisto papildas (66). Klinikinėse laboratorijose plačiai naudojami biotinilinti reagentai dėl gebėjimo stipriai, nekovalentiniais ryšiais, prisijungti prie streptavidino, kuris yra pritvirtintas prie kieto paviršiaus, tokio kaip magnetinės granulės, arba su fermentais sujungto imunosorbcinio tyrimo plokštelės. Atliekant laisvųjų T4, T3, tirotropino ir tirotropino receptorių antikūnų tyrimus, dažniausiai įtraukiamas biotinilinimas (67). Yra daugybė pranešimų apie klaidingus su biotinu susijusius tyrimų rezultatus, dėl kurių neteisingai diagnozuojamos ir gydomos ligos, įskaitant atvejus, kai klaidingai maži tirotropino lygio, klaidingai dideli laisvojo T4 lygio ir klaidingai teigiami tirotropino receptorių antikūnų tyrimų rezultatai tiksliai atkartojo Graveso ligos biocheminius duomenis (68). Tokie klaidingi tyrimo rezultatai pastebimi, kai biotino dozė yra 300 mg/p. ar didesnė, o mažesni tyrimo rezultatų iškraipymai atsiranda vartojant biotino ne mažiau kaip 10 mg/p. (69–72). Atsiradusių neatitikimų nuokrypis ir laipsnis priklauso nuo pasirinkto tyrimo: ELISA (angl. Enzyme-Linked ImmunoSorbent Assay) tipo metodas, dažniausiai taikomas nustatant tirotropino lygį, rodo klaidingai mažas vertes, o konkurencinio imuninio tyrimo (ELISA) metu nustatomas klaidingai padidėjęs skydliaukės hormonų kiekis (1).
Vartojant biotino papildus, skydliaukės laboratorinių tyrimų rezultatai gali būti klaidingi, tad prieš atliekant tyrimus reikėtų paklausti pacientų, ar jie nevartoja šių papildų. Tyrimo neatitikimai dažnai išnyksta per 48 val. po biotino vartojimo nutraukimo, tačiau prieš pakartojant testą pacientai turėtų keletą dienų nevartoti biotino papildų (73).
Amiodaronas
Amiodaronas sukelia ne tik hipotiroidizmą ir tirotoksikozę, tačiau pacientams, kurių skydliaukės veikla yra nesutrikusi, gali sukelti ir nuspėjamus pokyčius skydliaukės laboratoriniuose tyrimuose. Amiodaronas ir jo pagrindinis aktyvus metabolitas, destilamiodaronas, slopina T4 pavertimą į T3, tuomet sumažėja cirkuliuojančio ir hipofizėje esančio T3 kiekis ir neigiamojo grįžtamojo ryšio principu stimuliuojamas tirotropiną atpalaiduojančio hormono ir tirotropino išsiskyrimas. Padidėjęs tirotropino kiekis skatina skydliaukėje išsiskirti T4, kuris kaupiasi organizme, nes yra slopinamas jo virtimas į T3. Atlikus kraujo tyrimus pacientui, kurio skydliaukės funkcija yra normali, pastebimas šių pokyčių grandininis efektas: padidėjęs tirotropino lygis (arba ties aukščiausia normalaus lygio riba), didelis bendrojo ir laisvo T4 lygis bei T3 lygis ties žemiausia normalaus lygio riba. Nustačius padidėjusį T4 kiekį, galima klaidingai įtarti pirminę tirotoksikozę, tačiau tokią galimybę reikėtų atmesti, kol nenustatytas tirotropino kiekis. Padidėjęs tirotropino ir laisvojo T4 kiekis gali būti klaidingai laikomi tirotropiną išskiriančios hipofizės adenomos ar skydliaukės hormonų atsparumo įrodymais, tačiau jei skydliaukės tyrimai buvo atlikti prieš pradedant gydymą amiodaronu ir atitiko normą, šių sutrikimų galimybė yra paneigiama. Pacientams, kurių skydliaukės funkcija yra normali ir kurie yra gydomi levotiroksinu, pradėjus vartoti amiodaroną gali panašiai padidėti tirotropino kiekis (74).
Heparinas
Heparinas atpalaiduoja lipoproteinų lipazę iš kraujagyslių endotelio. Kraujo mėginiai iš paciento, vartojančio hepariną, padidina lipoproteinų lipazės aktyvumą, kuris išlieka in vitro. Labiausiai paveikiami laisvųjų skydliaukės hormonų tyrimai su užsitęsusiu inkubacijos laikotarpiu (pvz., atliekant pusiausvyros dializę), nes lipazės išskiriamos laisvosios riebalų rūgštys išstumia T4 ir T3 iš skydliaukės hormonus surišančių baltymų ir sukelia nepatikimas tyrimų reikšmes (75). Panašus poveikis stebimas vartojant mažos molekulinės masės heparino preparatus (76). Standartiniai konkurenciniai laisvųjų hormonų ir tirotropino tyrimai paprastai nepakinta, todėl testus galima pakartoti naudojant šiuos tyrimus arba reikšmes galima patikrinti praėjus 24 val. po heparino vartojimo nutraukimo (1).
Fenitoinas, karbamazepinas ir salsalatas
Fenitoinas ir karbamazepinas ne tik skatina skydliaukės hormonų metabolizmą, bet ir išstumia T4 iš skydliaukės hormonus surišančių baltymų. Nors tiesioginis poveikis pasireiškia trumpalaikiu laisvojo T4 kiekio padidėjimu kartu su ekvivalentišku tirotropino slopinimu, tikimasi, kad pasiekus pusiausvyrą abiejų hormonų lygiai normalizuosis. Kažkada atrodė paradoksalu, kad kliniškai normaliai funkcionuojančią skydliaukę turintiems pacientams, vartojantiems šiuos vaistus, buvo nustatytas mažas laisvojo T4 ir normalus tirotropino kiekis, kas leido įtarti centrinį hipotiroidizmą. Vėliau nustatyta, kad gautos sumažėjusios laisvojo T4 vertės yra klaidingos ir susijusios tyrimais, kuriuos atliekant yra būtinas serumo praskiedimas (77). Panašus poveikis pastebimas ir vartojant salsalatą (78).
Skydliaukės funkcijos sutrikimų poveikis vaistų metabolizmui
Hipertiroidizmas ir hipotiroidizmas gali paveikti vaistų farmakokinetiką ir veiksmingumą, taip pat nepageidaujamų reiškinių dažnį. Svarbiausi pavyzdžiai yra varfarinas, kurio sergant hipertiroidzimu reikia neužtikrintai intuityviai mažesnės dozės, todėl padidėja nuo vitamino K priklausomų krešėjimo faktorių apykaita, ir statinų, kurie yra susiję su padidėjusia miopatijos rizika esant hipotireozei (79–81). Hipertiroidizmas pagreitina daugelio vaistų, įskaitant propranololį, širdies glikozidus ir gliukokortikoidus, metabolizmą, o hipotiroidizmas sumažina (sutrikdo) šių vaistų klirensą (82).
Apibendrinimas
Vaistai gali įvairiai veikti skydliaukę – sutrikdyti skydliaukės kontrolę pogumburio ir hipofizės lygmeniu, inicijuoti imuninę ir neimuninę skydliaukės destrukciją, sukelti ar apsunkinti skydliaukės autoimuninius sutrikimus, inicijuoti hipotiroidizmą ar tirotoksikozę. Vaistai turi įtaką skydliaukės hormonų prisijungimui prie baltymų nešiklių bei T4 pavertimui į T3, skydliaukės hormonų apykaitai ir perdirbimui. Daugybė vaistų daro įtaką egzogeninės skydliaukės hormonų terapijos veiksmingumui, todėl reikia būti budriems, kad būtų išvengta nepakankamo gydymo vartojant vaistus, tiek perteklinio gydymo nutraukus jų vartojimą. Vaistai gali pakeisti skydliaukės laboratorinių tyrimų rezultatus taip, kad šie dirbtinai imituotų Graveso ligą, centrinį hipotiroidizmą ir centrinį hipertiroidizmą pacientams, kurių skydliaukės veikla nėra sutrikusi. Gydytojai, žinodami apie galimas sąveikas, gali stebėti pacientus, prireikus įsikišti ir išvengti nereikalingų tyrimų bei gydymo (1).
Leidinys "Internistas" Nr. 9, 2019 m.
Ieva Čalkaitė
Lietuvos sveikatos mokslų universitetas
LITERATŪRA
1. Henry B. Burch, M. D. Drug Effects on the Thyroid The new England journal of medicine August 22, 2019 749-761
2. Brent GA. Mechanisms of thyroid hormone action. J Clin Invest 2012; 122:3035-43.
3. Kopp P. Thyroid hormone synthesis. In: Braverman LE, Cooper DS, eds. Werner & Ingbar’s the thyroid: a fundamental and clinical text. 10th ed. Philadelphia: Lippincott Williams & Wilkins, 2013: 48-74.
4. van der Spek AH, Fliers E, Boelen A. The classic pathways of thyroid hormone metabolism. Mol Cell Endocrinol 2017; 458: 29-38.
5. Sherman SI, Gopal J, Haugen BR, et al. Central hypothyroidism associated with retinoid X receptor–selective ligands. N Engl J Med 1999; 340: 1075-9.
6. Duvic M, Martin AG, Kim Y, et al. Phase 2 and 3 clinical trial of oral bexarotene (Targretin capsules) for the treatment of refractory or persistent earlystage cutaneous T-cell lymphoma. Arch Dermatol 2001; 137: 581-93.
7. Smit JW, Stokkel MP, Pereira AM, Romijn JA, Visser TJ. Bexarotene-induced hypothyroidism: bexarotene stimulates the peripheral metabolism of thyroid hormones. J Clin Endocrinol Metab 2007; 92:2496-9.
8. Russo M, Scollo C, Pellegriti G, et al. Mitotane treatment in patients with adrenocortical cancer causes central hypothyroidism. Clin Endocrinol (Oxf) 2016; 84:614-9.
9. Daffara F, De Francia S, Reimondo G, et al. Prospective evaluation of mitotane toxicity in adrenocortical cancer patients treated adjuvantly. Endocr Relat Cancer 2008; 15: 1043-53.
10. Chang LS, Barroso-Sousa R, Tolaney SM, Hodi FS, Kaiser UB, Min L. Endocrine toxicity of cancer immunotherapy targeting immune checkpoints. Endocr Rev 2019; 40: 17-65.
11. Corsello SM, Barnabei A, Marchetti P, De Vecchis L, Salvatori R, Torino F. Endocrine side effects induced by immune checkpoint inhibitors. J Clin Endocrinol Metab 2013; 98: 1361-75.
12. Barroso-Sousa R, Barry WT, Garrido- Castro AC, et al. Incidence of endocrine dysfunction following the use of different immune checkpoint inhibitor regimens: a systematic review and meta-analysis. JAMA Oncol 2018; 4: 173-82.
13. Brilli L, Danielli R, Ciuoli C, et al. Prevalence of hypophysitis in a cohort of patients with metastatic melanoma and prostate cancer treated with ipilimumab. Endocrine 2017; 58: 535-41.
14. Lupoli R, Di Minno A, Tortora A, Ambrosino P, Lupoli GA, Di Minno MN. Effects of treatment with metformin on TSH levels: a meta-analysis of literature studies. J Clin Endocrinol Metab 2014; 99: E143-E148.
15. Beck-Peccoz P, Rodari G, Giavoli C, Lania A. Central hypothyroidism — a neglected thyroid disorder. Nat Rev Endocrinol 2017; 13: 588-98.
16. Leung AM, Braverman LE. Iodineinduced thyroid dysfunction. Curr Opin Endocrinol Diabetes Obes 2012; 19: 414-9.
17. Ross DS, Burch HB, Cooper DS, et al. 2016 American Thyroid Association guidelines for diagnosis and management of hyperthyroidism and other causes of thyrotoxicosis. Thyroid 2016; 26: 1343-421.
18. Martino E, Bartalena L, Bogazzi F, Braverman LE. The effects of amiodarone on the thyroid. Endocr Rev 2001; 22: 240-54.
19. Perrild H, Hegedus L, Baastrup PC, Kayser L, Kastberg S. Thyroid function and ultrasonically determined thyroid size in patients receiving long-term lithium treatment. Am J Psychiatry 1990; 147: 1518-21.
20. Lazarus JH. Lithium and thyroid. Best Pract Res Clin Endocrinol Metab 2009; 23: 723-33.
21. McKnight RF, Adida M, Budge K, Stockton S, Goodwin GM, Geddes JR. Lithium toxicity profile: a systematic review and meta-analysis. Lancet 2012; 379: 721-8.
22. Kraszewska A, Chlopocka-Wozniak M, Abramowicz M, Sowinski J, Rybakowski JK. A cross-sectional study of thyroid function in 66 patients with bipolar disorder receiving lithium for 10-44 years. Bipolar Disord 2015; 17: 375-80.
23. Miller KK, Daniels GH. Association between lithium use and thyrotoxicosis caused by silent thyroiditis. Clin Endocrinol (Oxf) 2001; 55: 501-8.
24. Ryder M, Callahan M, Postow MA, Wolchok J, Fagin JA. Endocrine-related adverse events following ipilimumab in patients with advanced melanoma: a comprehensive retrospective review from a single institution. Endocr Relat Cancer 2014; 21: 371-81.
25. Morganstein DL, Lai Z, Spain L, et al. Thyroid abnormalities following the use of cytotoxic T-lymphocyte antigen-4 and programmed death receptor protein-1 inhibitors in the treatment of melanoma. Clin Endocrinol (Oxf) 2017; 86: 614-20.
26. Bertrand A, Kostine M, Barnetche T, Truchetet ME, Schaeverbeke T. Immune related adverse events associated with anti- CTLA-4 antibodies: systematic review and meta-analysis. BMC Med 2015; 13: 211.
27. Scott ES, Long GV, Guminski A, Clifton- Bligh RJ, Menzies AM, Tsang VH. The spectrum, incidence, kinetics and management of endocrinopathies with immune checkpoint inhibitors for metastatic melanoma. Eur J Endocrinol 2018; 178: 173-80.
28. de Filette J, Jansen Y, Schreuer M, et al. Incidence of thyroid-related adverse events
in melanoma patients treated with pembrolizumab. J Clin Endocrinol Metab 2016; 101: 4431-9.
29. Lee H, Hodi FS, Giobbie-Hurder A, et al. Characterization of thyroid disorders in patients receiving immune checkpoint inhibition therapy. Cancer Immunol Res 2017; 5: 1133-40.
30. McMillen B, Dhillon MS, Yong-Yow S. A rare case of thyroid storm. BMJ Case Rep 2016; 2016: bcr2016214603.
31. Iyer PC, Cabanillas ME, Waguespack SG, et al. Immune-related thyroiditis with immune checkpoint inhibitors. Thyroid 2018; 28: 1243-51.
32. Jonklaas J, Bianco AC, Bauer AJ, et al. Guidelines for the treatment of hypothyroidism: prepared by the American Thyroid Association Task Force on Thyroid Hormone Replacement. Thyroid 2014; 24: 1670-751.
33. Postow MA, Sidlow R, Hellmann MD. Immune-related adverse events associated with immune checkpoint blockade. N Engl J Med 2018; 378: 158-68.
34. Kimbara S, Fujiwara Y, Iwama S, et al. Association of antithyroglobulin antibodies with the development of thyroid dysfunction induced by nivolumab. Cancer Sci 2018; 109: 3583-90.
35. Yamauchi I, Sakane Y, Fukuda Y, et al. Clinical features of nivolumab-induced thyroiditis: a case series study. Thyroid 2017; 27: 894-901.
36. Osorio JC, Ni A, Chaft JE, et al. Antibody- mediated thyroid dysfunction during T-cell checkpoint blockade in patients with non-small-cell lung cancer. Ann Oncol 2017; 28: 583-9.
37. Krouse RS, Royal RE, Heywood G, et al. Thyroid dysfunction in 281 patients with metastatic melanoma or renal carcinoma treated with interleukin-2 alone. J Immunother Emphasis Tumor Immunol 1995; 18: 272-8.
38. Mammen JS, Ghazarian SR, Pulkstenis E, Subramanian GM, Rosen A, Ladenson PW. Phenotypes of interferon-α-induced thyroid dysfunction among patients treated for hepatitis C are associated with pretreatment serum TSH and female sex.
J Clin Endocrinol Metab 2012; 97: 3270-6.
39. Kruit WH, Bolhuis RL, Goey SH, et al. Interleukin-2-induced thyroid dysfunction is correlated with treatment duration but not with tumor response. J Clin Oncol 1993; 11: 921-4.
40. Daniels GH, Vladic A, Brinar V, et al. Alemtuzumab-related thyroid dysfunction in a phase 2 trial of patients with relapsing- remitting multiple sclerosis. J Clin Endocrinol Metab 2014; 99: 80-9.
41. Pariani N, Willis M, Muller I, et al. Alemtuzumab-induced thyroid dysfunction exhibits distinctive clinical and immunological features. J Clin Endocrinol Metab 2018; 103: 3010-8.
42. Ferrajoli A, O’Brien SM, Cortes JE, et al. Phase II study of alemtuzumab in chronic lymphoproliferative disorders. Cancer 2003; 98: 773-8.
43. Lorenzi AR, Clarke AM, Wooldridge T, et al. Morbidity and mortality in rheumatoid arthritis patients with prolonged therapy-induced lymphopenia: twelve-year outcomes. Arthritis Rheum 2008; 58: 370-5.
44. Baker D, Herrod SS, Alvarez-Gonzalez C, Giovannoni G, Schmierer K. Interpreting lymphocyte reconstitution data from the pivotal phase 3 trials of alemtuzumab. JAMA Neurol 2017; 74: 961-9.
45. Chen F, Day SL, Metcalfe RA, et al. Characteristics of autoimmune thyroid disease occurring as a late complication of immune reconstitution in patients with advanced human immunodeficiency virus (HIV) disease. Medicine (Baltimore) 2005; 84: 98-106.
46. Basaria S, Cooper DS. Amiodarone and the thyroid. Am J Med 2005; 118: 706- 14.
47. Bartalena L, Bogazzi F, Chiovato L, Hubalewska-Dydejczyk A, Links TP, Vanderpump M. 2018 European Thyroid Association (ETA) guidelines for the management of amiodarone-associated thyroid dysfunction. Eur Thyroid J 2018; 7: 55-66.
48. Illouz F, Braun D, Briet C, Schweizer U, Rodien P. Endocrine side-effects of anti-cancer drugs: thyroid effects of tyrosine kinase inhibitors. Eur J Endocrinol 2014; 171: R91-R99.
49. Desai J, Yassa L, Marqusee E, et al. Hypothyroidism after sunitinib treatment for patients with gastrointestinal stromal tumors. Ann Intern Med 2006; 145: 660-4.
50. Motzer RJ, Hutson TE, Tomczak P, et al. Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma. J Clin Oncol 2009; 27: 3584-90.
51. Motzer RJ, McCann L, Deen K. Pazopanib versus sunitinib in renal cancer. N Engl J Med 2013; 369: 1970.
52. Motzer RJ, Tannir NM, McDermott DF, et al. Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018; 378: 1277-90.
53. Arafah BM. Increased need for thyroxine in women with hypothyroidism during estrogen therapy. N Engl J Med 2001; 344: 1743-9.
54. Shifren JL, Desindes S, McIlwain M, Doros G, Mazer NA. A randomized, openlabel, crossover study comparing the effects of oral versus transdermal estrogen therapy on serum androgens, thyroid hormones, and adrenal hormones in naturally menopausal women. Menopause 2007; 14: 985-94.
55. Warnock AL, Cooper DS, Burch HB. Life-threatening thyrotoxicosis. In: Matfin G, ed. Endocrine and metabolic medical emergencies: a clinician’s guide. 2nd ed. Hoboken, NJ: John Wiley, 2018: 262-83.
56. Curran PG, DeGroot LJ. The effect of hepatic enzyme-inducing drugs on thyroid hormones and the thyroid gland. Endocr Rev 1991; 12: 135-50.
57. Kim HI, Kim TH, Kim H, et al. Effect of rifampin on thyroid function test in patients on levothyroxine medication. PLoS One 2017; 12(1): e0169775.
58. Abdulrahman RM, Verloop H, Hoftijzer H, et al. Sorafenib-induced hypothyroidism is associated with increased type 3 deiodination. J Clin Endocrinol Metab 2010; 95: 3758-62.
59. Solomon BL, Wartofsky L, Burman KD. Adjunctive cholestyramine therapy for thyrotoxicosis. Clin Endocrinol (Oxf) 1993; 38: 39-43.
60. Shakir KM, Michaels RD, Hays JH, Potter BB. The use of bile acid sequestrants to lower serum thyroid hormones in iatrogenic hyperthyroidism. Ann Intern Med 1993; 118: 112-3.
61. Hays MT. Localization of human thyroxine absorption. Thyroid 1991; 1: 241-8.
62. Virili C, Antonelli A, Santaguida MG, Benvenga S, Centanni M. Gastrointestinal malabsorption of thyroxine. Endocr Rev 2019; 40: 118-36.
63. Centanni M, Gargano L, Canettieri G, et al. Thyroxine in goiter, Helicobacter pylori infection, and chronic gastritis. N Engl J Med 2006; 354: 1787-95.
64. Sachmechi I, Reich DM, Aninyei M, Wibowo F, Gupta G, Kim PJ. Effect of proton pump inhibitors on serum thyroidstimulating hormone level in euthyroid patients treated with levothyroxine for hypothyroidism. Endocr Pract 2007; 13: 345-9.
65. Vita R, Saraceno G, Trimarchi F, Benvenga S. Switching levothyroxine from the tablet to the oral solution formulation corrects the impaired absorption of levothyroxine induced by proton-pump inhibitors. J Clin Endocrinol Metab 2014; 99: 4481-6.
66. Kantor ED, Rehm CD, Du M, White E, Giovannucci EL. Trends in dietary supplement use among US adults from 1999- 2012. JAMA 2016; 316: 1464-74.
67. Favresse J, Burlacu MC, Maiter D, Gruson D. Interferences with thyroid function immunoassays: clinical implications and detection algorithm. Endocr Rev 2018; 39: 830-50.
68. Kummer S, Hermsen D, Distelmaier F. Biotin treatment mimicking Graves’ disease. N Engl J Med 2016; 375: 704-6.
69. Samarasinghe S, Meah F, Singh V, et al. Biotin interference with routine clinical immunoassays: understand the causes and mitigate the risks. Endocr Pract 2017; 23: 989-98.
70. Elston MS, Sehgal S, Du Toit S, Yarndley T, Conaglen JV. Factitious Graves’ disease due to biotin immunoassay interference — a case and review of the literature. J Clin Endocrinol Metab 2016; 101: 3251-5.
71. Li D, Radulescu A, Shrestha RT, et al. Association of biotin ingestion with performance of hormone and nonhormone assays in healthy adults. JAMA 2017; 318: 1150-60.
72. Biscolla RPM, Chiamolera MI, Kanashiro I, Maciel RMB, Vieira JGH. A single 10 mg oral dose of biotin interferes with thyroid function tests. Thyroid 2017; 27: 1099-100.
73. Wijeratne NG, Doery JC, Lu ZX. Positive and negative interference in immunoassays following biotin ingestion: a pharmacokinetic study. Pathology 2012; 44: 674-5.
74. Figge J, Dluhy RG. Amiodarone-induced elevation of thyroid stimulating hormone in patients receiving levothyroxine for primary hypothyroidism. Ann Intern Med 1990; 113: 553-5.
75. Mendel CM, Frost PH, Kunitake ST, Cavalieri RR. Mechanism of the heparininduced increase in the concentration of free thyroxine in plasma. J Clin Endocrinol Metab 1987; 65: 1259-64.
76. Stevenson HP, Archbold GP, Johnston P, Young IS, Sheridan B. Misleading serum free thyroxine results during low molecular weight heparin treatment. Clin Chem 1998; 44: 1002-7.
77. Surks MI, DeFesi CR. Normal serum free thyroid hormone concentrations in patients treated with phenytoin or carbamazepine: a paradox resolved. JAMA 1996; 275: 1495-8.
78. McConnell RJ. Abnormal thyroid function test results in patients taking salsalate. JAMA 1992; 267: 1242-3.
79. Kurnik D, Loebstein R, Farfel Z, Ezra D, Halkin H, Olchovsky D. Complex drugdrug- disease interactions between amiodarone, warfarin, and the thyroid gland. Medicine (Baltimore) 2004; 83: 107-13.
80. Krieger EV, Knopp RH. Hypothyroidism misdiagnosed as statin intolerance. Ann Intern Med 2009; 151: 72.
81. Lando HM, Burman KD. Two cases of statin-induced myopathy caused by induced hypothyroidism. Endocr Pract 2008; 14: 726-31.
82. Shenfield GM. Influence of thyroid dysfunction on drug pharmacokinetics. Clin Pharmacokinet 1981; 6: 275-97.

