2019 metų lėtinių koronarinių sindromų diagnostikos ir gydymo rekomendacijų apžvalga (I dalis)
Gyd. Gediminas Aučina
Vilniaus universiteto Medicinos fakultetas
Įvadas
Vainikinių arterijų liga (VAL) – tai patologinis procesas, kai aterosklerotinės plokštelės kaupiasi epikardinėse kraujagyslėse ir gali sukelti jų užsikimšimą. Šiai ligai būdingi ilgos ir stabilios eigos periodai, bet VAL eiga gali staiga tapti nestabili plyšus plokštelei ar pasireiškus erozijai. VAL gali būti klasifikuojama į ūminius ir lėtinius koronarinius sindromus (ŪKS ir LKS). Šiame straipsnyje aptariami pagrindiniai 2019 metų atnaujintų Europos kardiologų draugijos (EKD) gairių aspektai, kuriose daugiau dėmesio skiriama LKS, o ne stabiliajai VAL. Pasenusio termino stabilioji VAL naujose rekomendacijose atsisakoma, nes siekiama pabrėžti, kad ligai būdinga progresuojanti eiga ir reikia imtis prevencinių priemonių prieš galimus kardiovaskulinius (KV) įvykius ateityje. Gerinant diagnostiką ir gydymą skirtingais LKS eigos periodais, 2019 metų EKD gairėse išskiriamos dažniausios 6 klinikinės pacientų grupės:
1) pacientai, kuriems įtariama VAL ir stabilūs krūtinės anginos (KA) simptomai ir / ar dusulys;
2) pacientai, kuriems naujai išsivystė širdies nepakankamumas (ŠN) ar kairiojo skilvelio (KS) disfunkcija ir yra įtariama VAL;
3) pacientai, kuriems stabilizuoti simptomai iki 1 metų po ŪKS arba su neseniai atlikta revaskuliarizacija;
4) pacientai >1 metai po pradinės diagnozės ar revaskuliarizacijos;
5) pacientai, kurie serga KA ir kuriems įtariama vazospastinė ar mikrovaskuline liga;
6) asimptominiai pacientai, kuriems VAL nustatyta atrankinio tyrimo metu.
Remiantis šiuo pacientų skirstymu, parengtos naujausios LKS rekomendacijos, siekiant palengvinti jų naudojimą klinikinėje praktikoje (1). Pirmoje straipsnio dalyje bus apžvelgtos rekomendacijos, susijusios su pirmąja pacientų grupe. Kitame žurnalo numeryje apžvelgsime likusias 5 klinikines pacientų grupes.
Pacientai, sergantys KA ir / ar dusuliu bei įtariama VAL
Diagnostika ir rizikos vertinimas
Šios pacientų grupės diagnostinis algoritmas pateikiamas 1 pav. Jį sudaro 6 žingsniai. Po šių žingsnių seka atitinkamas tolesnis gydymas, kurį sudaro gyvensenos korekcija, medikamentinis gydymas ir revaskuliarizacija (kai yra indikacijų ją atlikti).
1 pav. Pacientų, sergančių KA, pradinis diagnostinis įvertinimas įtariant VAL

ŪKS – ūminiai koronariniai sindromai, VAL – vainikinių arterijų liga, KTA – kompiuterinės tomografijos angiografija, KSIF – kairiojo skilvelio išstūmio frakcija, MTR – momentinis tėkmės rezervas, FTR – frakcinis tėkmės rezervas.
a Prieš skiriant gydymą, pagrįsti miokardo išemiją funkciniais neinvaziniais vaizdinimo tyrimais. b Gali būti neatlikta labai jauniems ir sveikiems pacientams, kuriems yra labiau tikėtinas neširdinis krūtinės skausmas, arba keliomis gretutinėmis ligomis sergantiems pacientams, kuriems kardioechoskopija neturės įtakos tolesniam gydymui.
c Spręsti dėl krūvio EKG – vertinti simptomus, aritmijas, fizinį pajėgumą, kraujospūdžio atsaką ir įvykių riziką atrinktiems pacientams.
d Krūvio toleravimas, individualios paciento rizikos tyrimo metu ir tikimybė gauti tyrimo rezultatą.
e Didelė klinikinė tikimybė ir išliekantys simptomai skiriant gydymą, didelė įvykių rizika, kuri pagrįsta klinikiniu įvertinimu (pvz., ST segmento depresija kartu su simptomais, esant mažam fiziniam krūviui ar sistolinei disfunkcijai, rodančiai VAL) arba neaiški diagnozė atliekant neinvazinius tyrimus.
f Funkcinis miokardo išemijos vertinimas, jei vainikinių arterijų KTA nenustatytas VAL reikšmingumas ar ji neinformatyvi.
g Apsvarstyti ir neobstrukcinę anginą epikardinėse vainikinėse arterijose.
Vertinant klinikinius simptomus, KA galima suskirstyti į 3 tipus:
1) tipinė KA, kai yra 3 simptomai: spaudžiantis skausmas krūtinėje, galintis plisti į kaklą, apatinį žandikaulį, petį ar ranką; skausmas paūmėja fizinio krūvio metu; skausmas nurimsta ramybėje ar pavartojus nitratų per 5 min.;
2) atipinė KA, kai yra 2 minėti simptomai;
3) neangininis krūtinės skausmas, kai yra vienas arba nėra minėtų simptomų.
Naujai išsivysčiusi KA dažniausiai yra būdinga ŪKS, bet jeigu KA pirmą kartą pasireiškia sunkaus fizinio krūvio metu ir išnyksta ramybėje, tai labiau būdinga LKS nei nestabiliajai KA (1).
Pacientams, kuriems įtariama VAL, pradinio ištyrimo metu rekomenduojama atlikti šiuos laboratorinius tyrimus:
1) troponino koncentraciją, jei kliniškai įtariamas ŪKS (rekomendacijų klasė / įrodymų lygmuo – I/A) (2, 3);
2) bendrąjį kraujo tyrimą (I/B) (4);
3) kreatinino koncentraciją ir apskaičiuoti inkstų funkciją – glomerulų filtracijos greitį (I/A) (5, 6);
4) lipidogramą (I/A) (7, 8);
5) ištirti dėl galimo 2 tipo cukrinio diabeto (CD) – glikozilintas hemoglobinas ir gliukozės koncentraciją nevalgius, gliukozės tolerancijos testas (I/B) (9, 10);
6) įtariant skydliaukės patologiją – skydliaukės funkcijos rodiklius (I/C).
Į pradinį paciento ištyrimą įeina šie instrumentiniai tyrimai:
1) ramybės elektrokardiograma (EKG);
2) ambulatorinis EKG užrašymas;
3) ramybės ultragarsinis širdies tyrimas;
4) krūtinės ląstos rentgenograma.
Ramybės EKG rekomenduojama atlikti visiems pacientams, kurie jaučia krūtinės skausmą arba yra po praėjusio KA epizodo (I/C). VAL diagnozė neturėtų būti pagrįsta ST segmento pokyčiais, kai EKG užrašoma esant supraventrikulinei tachiaritmijai (III/C). Ambulatorinis EKG užrašymas rekomenduojamas tada, kai yra krūtinės skausmas ir įtariama aritmija (I/C), taip pat gali būti atliekamas pacientams, kuriems įtariama vazospastinė KA (IIa/C), bet neturėtų būti naudojamas kaip rutininis tyrimas visiems pacientams, kuriems įtariami LKS (III/C). Transtorakinė kardioechosopija rekomenduojama, kai: 1) atliekama KA diferencinė diagnostika; 2) siekiama nustatyti regioninius KS sienelės judesio sutrikimus; 3) norima įvertinti KS išstūmio frakciją, diastolinę funkciją (I/B) (11–14). Miego arterijų ultragarsinis ištyrimas galėtų būti atliekamas įtariant LKS (IIa/C). Širdies magnetinio rezonanso tomografija galėtų būti svarstoma atlikti, kai kardioechoskopija yra neinformatyvi (IIb/C). Krūtinės rentgenogramą rekomenduojama atlikti pacientams, kuriems klinika yra atipinė, yra ŠN požymių ar įtariama plaučių liga (I/C) (1).
Obstrukcinės VAL tikimybė priklauso nuo ligos paplitimo ir konkretaus paciento klinikinių požymių. Pretestinė obstrukcinės VAL tikimybė (PTT) gali būti apskaičiuota naudojant paprastą modelį, sudarytą remiantis paciento amžiumi, lytimi, klinika (1 lentelė) (15). Šis modelis galėtų iš esmės sumažinti tiek neinvazinių, tiek invazinių tyrimų poreikį, kai yra įtariamas LKS. Tyrimai parodė, kad pacientų, kurių PPT 15 proc., yra naudinga atlikti neinvazinį ištyrimą. Verta paminėti, kad šis PTT nustatymo modelis buvo sukurtas remiantis šalių, kuriose yra maža KV rizika, duomenimis, todėl gali būti netikslus mūsų regionui (1).
1 lentelė. Pretestinė obstrukcinės VAL tikimybė (proc.)
Tipinė |
Atipinė |
Neangininė |
Dusulys |
|||||
| Amžius | V | M | V | M | V | M | V | M |
| 30-39 | 3 | 5 | 4 | 3 | 1 | 1 | 0 | 3 |
| 40-49 | 22 | 10 | 10 | 6 | 3 | 2 | 12 | 3 |
| 50-59 | 32 | 13 | 17 | 6 | 11 | 3 | 20 | 9 |
| 60-69 | 44 | 16 | 26 | 11 | 22 | 6 | 27 | 14 |
| 70+ | 52 | 27 | 34 | 19 | 24 | 10 | 32 | 12 |
V – vyrai, M – moterys. Tamsiai žalia spalva pažymėtos pacientų grupės, kuriems nustatyta >15 proc. tikimybė ir jiems atlikti neinvazinį ištyrimą reikia labiausiai.
2 pav. Pagrindiniai simptominių pacientų, kuriems įtariama obstrukcinė VAL, ištyrimo būdai
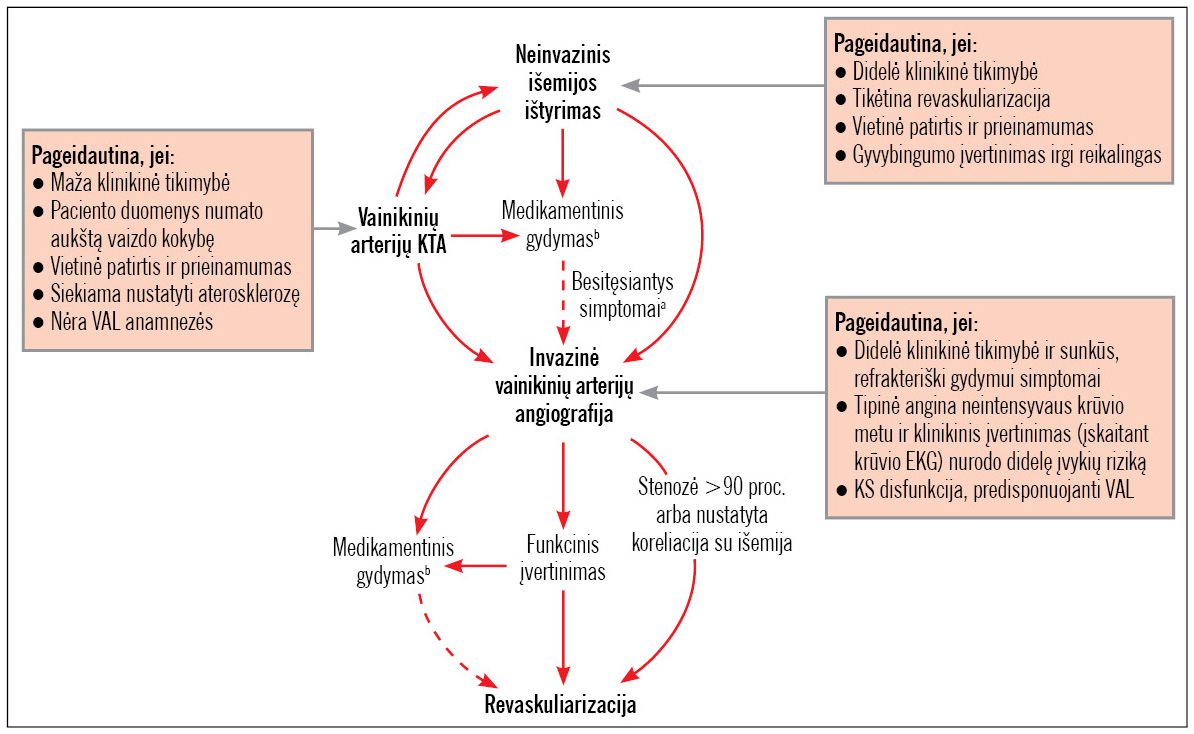
Atsižvelgiant į kliniką ir turimas diagnostines galimybes, paciento ištyrimas gali būti: neinvaziniai tyrimai, kompiuterinės tomografijos angiografija (KTA) ar invazinė vainikinių arterijų angiografija.
EKG – elektrokardiograma, KS – kairysis skilvelis, VAL – vainikinių arterijų liga.
a Svarstyti dėl mikrovaskulinės anginos.
b Antiangininiai vaistai ir / ar rizikos veiksnių modifikavimas.
Kai nėra tikslo atlikti revaskuliarizacijos dėl gretutinių ligų ir bendros gyvenimo kokybės, VAL galima diagnozuoti tik pagal klinikinius požymius ir skirti medikamentinį gydymą. Jei VAL diagnozė išlieka neaiški, neinvaziniai funkciniai vaizdinimo tyrimai galėtų padėti nustatyti miokardo išemiją dar iki pradedant gydymą. Pagrindiniai simptominių pacientų su įtariama obstrukcine VAL ištyrimo būdai pateikti 2 pav. Vainikinių arterijų kompiuterinės tomografijos angiografijai (KTA) gali būti teikiama pirmenybė, kai tiriami pacientai, kuriems būdinga mažesnė klinikinė VAL tikimybė ar kuriems anksčiau nebuvo diagnozuota VAL. Funkciniams neinvaziniams tyrimams teikiama pirmenybė, kai: 1) tiriami pacientai su nustatyta didesne klinikine VAL tikimybe ir tikimasi, kad bus atlikta revaskuliarizacija; 2) VAL jau yra diagnozuota. Esant neinformatyviems neinvaziniams tyrimams, reikia atlikti invazinę vainikinę angiografiją (IV/A). Detalesnės rekomendacijos, kaip pasirinkti vaizdinimo tyrimą, skirtą simptominiams pacientams, pateiktos 2 lentelėje.
Paskutinis diagnostikos algoritmo žingsnis (1 pav.) yra įvertinti simptominių pacientų, sergančių LKS, KV mirštamumo riziką ir identifikuoti didelės rizikos pacientus. Skirtingų diagnostinių tyrimų išvados, leidžiančios priskirti pacientą didelės rizikos grupei, pateiktos 3 lentelėje.
Gyvensenos korekcija, medikamentinis gydymas
Sveikos gyvensenos laikymasis (metimas rūkyti, fizinis aktyvumas, dieta, normalus svoris) kartu su tinkama antrine prevencija leidžia sumažinti KV įvykių pasikartojimo tikimybę ir mirštamumo riziką; nauda jau stebima praėjus 6 mėnesiams (29–32).
Medikamentinio gydymo tikslai yra mažinti KA simptomus ir fizinio krūvio sukeliamą išemiją, išvengti KV įvykių. Optimaliu medikamentiniu gydymu galima laikyti tokį, kuris leidžia pakankamai gerai kontroliuoti simptomus ir yra efektyvus KV įvykių prevencijai. Šiems tikslams siekti svarbu, kad pacientas maksimaliai laikytųsi paskirto gydymo režimo, ir minimalus medikamentinio gydymo nepageidaujamas poveikis (33–36). Reikėtų paminėti, kad nėra universalaus optimalaus gydymo apibrėžimo, medikamentinis gydymas turi būti pritaikytas individualiai (37). Pradinis medikamentinis gydymas dažniausiai susideda iš 1 ar 2 antiišeminių vaistų bei medikamentų, skirtų antrinei prevencijai (38). Nors dar nėra aišku, ar 2 antiišeminių vaistų deriniai, pavyzdžiui, beta adrenoblokatoriai su kalcio kanalų blokatoriais, yra pranašesni už gydymą monoterapija (39–42).
3 pav. pateikta pakopinė LKS pacientų ilgalaikio gydymo strategija, atsižvelgiant į jų tam tikrus klinikinius požymius. Esant nepakankamam atsakui ar prastai toleruojamam gydymui, šioje schemoje rekomenduojama pereiti prie kitame žingsnyje nurodytų vaistų. Ši strategija turėtų būti pritaikyta kiekvienam pacientui individualiai, ir nėra būtina skirti gydymą pažingsniui, kaip siūloma algoritme. Detalesnės LKS antiišeminio gydymo ir medikamentinės KV įvykių prevencijos rekomendacijos pateiktos 4 ir 5 lentelėse.
2 lentelė. Diagnostinių tyrimų rekomendacijos pradinio pacientų ištyrimo metu
| Vaizdinimo tyrimai pradinės diagnostikos metu įtariant VAL | Rekomendacijos klasė | Įrodymų lygmuo |
| *Neinvaziniai funkciniai vaizdinimo tyrimai, įvertinantys miokardo išemijąa, ar KTA rekomenduojami kaip pradiniai tyrimai VAL diagnostikai simptominiams pacientams, kai obstrukcinė VAL negali būti paneigta vien tik klinikiniu vertinimu (18–24) | I | B |
| * Rekomenduojama pradinį neinvazinį diagnostinį tyrimą pasirinkti atsižvelgiant į klinikinę VAL tikimybę ir kitus aspektus: galimybę atlikti tyrimą, vietinę patirtį, sugebėjimą atlikti tyrimą | I | C |
| * Rekomenduojami funkciniai miokardo išemijos vaizdinimo tyrimai, jei KTA neįvertinamas funkcinis VAL reikšmingumas ar tyrimas neinformatyvus (18, 20, 21) | I | B |
| * Invazinė VAA rekomenduojama kaip alternatyva diagnozuoti VAL pacientams, kuriems yra: 1) didelė klinikinė tikimybė ir ryškūs simptomai esant neefektyviam medikamentiniam gydymui; 2) tipinė KA, išsivysčiusi po nedidelio fizinio krūvio, ir pagal klinikinį vertinimą esant didelei įvykių rizikai. Invazinis funkcinis stenozės reikšmingumo įvertinimas turėtų būti prieinamas ir naudojamas prieš revaskuliarizaciją, išskyrus didelio laipsnio stenozes (>90 proc.) (25–27) |
I | B |
| * Turėtų būti svarstoma atlikti invazinę VAA, kai siekiama nustatyti VAL diagnozę esant neinformatyviems neinvaziniams tyrimams (25, 26) | IIa | B |
| * Turi būti sprendžiama dėl KTA kaip alternatyvos invazinei VAA, kai kiti neinvaziniai tyrimai negalimi ar nėra informatyvūs | IIa | C |
| * KTA nerekomenduojama, kai yra pažengusi vainikinių arterijų kalcifikacija, nereguliarus širdies ritmas, reikšmingas nutukimas, negebėjimas vykdyti paliepimą sulaikyti kvėpavimą ar kitomis aplinkybėmis, kai nesitikima geros vaizdo kokybės | III | C |
| VA kalcio įvertinimas KT nerekomenduojamas pacientams, sergantiems obstrukcine VAL | III | C |
Krūvio EKG atliekant pradinę diagnostiką įtarus VAL |
||
| Krūvio EKG rekomenduojama, kai siekiama įvertinti krūvio toleravimą, simptomus, aritmijas, kraujospūdžio atsaką ir KV įvykių riziką atrinktiems pacientams | I | C |
| Krūvio EKG gali būti svarstoma kaip alternatyva nustatyti ar atmesti VAL diagnozę, kai neinvazinis vaizdinimas neprieinamas (21, 28) | IIb | B |
| Krūvio EKG gali būti svarstoma atlikti norint įvertinti, kaip gydymas kontroliuoja simptomus ir išemiją | IIb | C |
| Krūvio EKG nerekomenduojama, kai ramybės EKG yra ≥0,1 mV ST segmento nusileidimas arba pacientas gydomas digoksinu | III | C |
EKG – elektrokardiograma, KT – kompiuterinė tomografija, KTA – kompiuterinės tomografijos angiografija, VA – vainikinės arterijos, VAL – vainikinių arterijų liga, VAA – vainikinių arterijų angiografija.
a Krūvio echokardioskopija, krūvio magnetinis rezonansas, vieno fotono emisijos kompiuterinė tomografija, pozitronų emisijos tomografija.
* 2019 metų rekomendacijų naujienos.
3 lentelė. Diagnostinių tyrimų apibrėžimai, padedantys priskirti pacientą didelės rizikos grupei
| Krūvio EKG | KV mirštamumas >3 proc. per 1 metus pagal Duke Treadmill skalę |
| SPECT ar PET | KS išemijos plotas ≥10 proc. |
| Krūvio kardioechoskopija | ≥3 iš 16 segmentų su krūvio sukelta hipokineze ar akineze |
| ŠMR | ≥2 iš 16 segmentų su krūvio perfuzijos defektais ar ≥3 iš 16 segmentų su dobutamino sukelta disfunkcija |
| VA KTA ar invazinė VAA | 3 VAL su proksimalinėmis stenozėmis, KVAK liga ar proksimalinės priekinės nusileidžiančiosios šakos liga |
| Invazinis funkcinis tyrimas | FTR ≤0,8, MTR ≤0,89 |
EKG – elektrokardiograma, KTA – kompiuterinės tomografijos angiografija, KV – kardiovaskulinis, KVAK – kairės vainikinės arterijos kamienas, VA – vainikinės arterijos, VAL – vainikinių arterijų liga, VAA – vainikinių arterijų angiografija, ŠMR – širdies magnetinis rezonansas, SPECT – vieno fotono emisijos kompiuterinė tomografija, PET – pozitronų emisijos tomografija, MTR – momentinis tėkmės rezervas, FTR – frakcinis tėkmės rezervas.
3 pav. Pakopinė ilgalaikio gydymo strategija
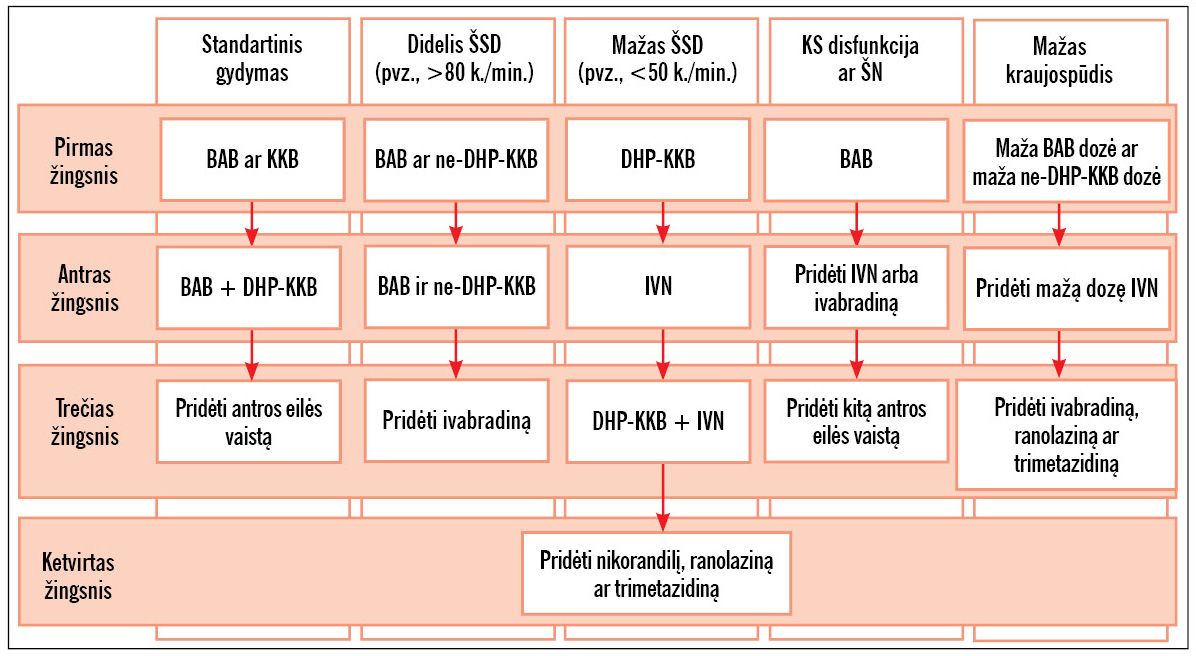
BAB – beta adrenoblokatorius, KKB – kalcio kanalų blokatorius, ne-DHP – nedihidropiridininis, DHP – dihidropiridininis, IVN – ilgo veikimo nitratai, ŠSD – širdies susitraukimų dažnis.
4 lentelė. Antiišeminio medikamentinio gydymo rekomendacijos*
| Antiišeminio medikamentinio gydymo rekomendacijos | Rekomendacijos klasė | Įrodymų lygmuo |
Bendrieji aspektai |
||
| Medikamentinį simptominių pacientų gydymą sudaro 1 ar daugiau vaistų, skirtų mažinti KA / išemiją, bei vaistas, skirtas KV įvykių prevencijai | I | C |
| Yra rekomenduojamas pacientų mokymas apie savo ligą, rizikos veiksnius ir gydymo strategiją | I | C |
| Rekomenduojama periodiškai tikrinti atsaką į gydymą | I | C |
Antiišeminis gydymas |
||
| Trumpo poveikio nitratai rekomenduojami neatidėliotinam KA palengvinimui | I | B |
| Pirmojo pasirinkimo gydymui rekomenduojami BAB ir / ar KKB, skirti kontroliuoti širdies ritmą ir simptomus | I | A |
| Jei KA nepakankamai kontroliuojama BAB ir / ar KKB, patariama apsvarstyti BAB ir DHP-KKB derinį | IIa | C |
| Turi būti svarstoma dėl BAB ir DHP-KKB derinio kaip pradinio pirmojo pasirinkimo medikamentų | IIa | B |
| Turi būti sprendžiama dėl ilgo veikimo nitratų kaip antrojo pasirinkimo medikamentų, kai pradinis gydymas su BAB ir / ar DHP-KKB yra kontraindikuotinas, blogai toleruojamas ar blogai kontroliuoja KA simptomus | IIa | B |
| Skiriant ilgo veikimo nitratus, turi būti numatomas laikotarpis be nitratų vartojimo ar trumpas nitratų skyrimo intervalas, kad sumažėtų tolerancijos išsivystymo rizika | IIa | B |
| Gali būti sprendžiama dėl nikorandilio, ranolazino, ivabradino ar trimetazidino kaip antrojo pasirinkimo medikamentų, mažinančių KA dažnį, gerinančių FK toleravimą pacientams, kurie netoleruoja gydymo, turi kontraindikacijų ar jų simptomų nepavyksta kontroliuoti BAB, KKB ir ilgo veikimo nitratais | IIa | B |
| Pacientams, kurių mažas ŠSD ir mažas AKS, ranolazinas ar trimetazidinas gali būti skiriami kaip pirmojo pasirinkimo medikamentai KA dažniui mažinti ir FK toleravimui gerinti | IIb | C |
| Kai kuriems pacientams BAB ir / ar KKB derinys su antrojo pasirinkimo medikamentais (ranolazinu, nikorandiliu, ivabradinu ar trimetazidinu) gali būti skiriamas kaip pirmojo pasirinkimo gydymas, atsižvelgiant ŠSD, AKS ir vaistų toleravimą | IIb | B |
| Nitratų nerekomenduoja skirti pacientams, kuriems nustatyta hipertrofinė obstrukcinė kardiomiopatija, ar kartu su fosfodiesterazės inhibitoriais | III | B |
BAB – beta adrenoblokatorius, KKB – kalcio kanalų blokatorius, DHP – dihidropiridininis, AKS – arterinis kraujo spaudimas, ŠSD – širdies susitraukimų dažnis, FK – fizinis krūvis.
* 2019 metų rekomendacijų naujienos.
5 lentelė. Medikamentinio gydymo rekomendacijos, skirtos įvykių prevencijai
| Įvykių prevencija | Rekomendacijos klasė | Įrodymų lygmuo |
| Antitrombozinis gydymas pacientams, sergantiems LKS, esant sinusiniam ritmui | ||
| Rekomenduojama vartoti aspiriną 75–100 mg kasdien po persirgto MI ar revaskuliarizacijos | I | A |
| Rekomenduojama vartoti klopidogrelį 75 mg kasdien kaip alternatyvą, kai pacientas netoleruoja aspirino | I | B |
| Klopidogrelio skyrimas galėtų būti pranašesnis nei aspirino simptominiams ar asimptominiams pacientams, kurie serga PAL ar yra patyrę insultą / PSIP | IIb | B |
| Aspirino 75–100 mg kasdien skyrimas galėtų būti svarstomas pacientams be MI anamnezės ar revaskuliarizacijos, bet esant vaizdinimo tyrimais nustatytai VAL | IIb | C |
| *Antro antitrombozinio vaisto pridėjimas gydymo schemoje su aspirinu turėtų būti svarstomas ilgalaikei antrinei prevencijai pacientams, kuriems yra didelė išeminių įvykių rizika, o kraujavimo rizika nėra didelė | IIa | A |
| *Antro antitrombozinio vaisto pridėjimas gydymo schemoje su aspirinu galėtų būti svarstomas ilgalaikei antrinei prevencijai pacientams, kuriems nustatyta bent vidutinė išeminių įvykių rizika, o kraujavimo rizika nėra didelė | IIb | A |
| Antitrombozinis gydymas pacientams, sergantiems LKS, esant PV | ||
| *TPGA rekomenduojami labiau nei VKA | I | A |
| *Ilgalaikis gydymas GAK (TPGA ar VKA, kai INR >70 proc. terapiniame intervale) yra rekomenduojamas pacientams, sergantiems PV, ir CHA2DS2-VASc ≥2 vyrams ir ≥3 moterims | I | A |
| *Ilgalaikis gydymas GAK (TPGA ar VKA, kai INR >70 proc. terapiniame intervale) galėtų būti rekomenduojamas pacientams, sergantiems PV, ir CHA2DS2-VASc ≥1 vyrams ir ≥2 moterims | IIa | B |
| Aspirino 75–100 mg ar klopidogrelio 75 mg kasdien skyrimas kartu su ilgalaike GAK terapija pacientams sergant PV, buvus MI ir esant didelei pasikartojančių išeminių įvykių rizikai, kai kraujavimo rizika nėra didelė | IIb | B |
| Antitrombozinis gydymas pacientams, sergantiems LKS, po PVAI, esant sinusiniam ritmui | ||
| Po stentavimo rekomenduojamas aspirinas 75–100 mg kasdien | I | A |
| Kartu su aspirinu rekomenduojama skirti klopidogrelį (600 mg įsotinamąją dozę, vėliau 75 mg kasdien) 6 mėnesius po stentavimo, nepriklausomai nuo stento tipo, bet esant gyvybei grėsmingo kraujavimo rizikai skirti trumpiau – 1–3 mėnesius | I | A |
| Galėtų būti sprendžiama dėl klopidogrelio skyrimo trumpiau – 1 mėnesį, kai yra labai didelė gyvybei grėsmingo kraujavimo rizika | IIb | C |
| Prasugrelis ar tikagreloras galėtų būti svarstomi skirti pradiniam gydymui, kai yra specifinės didelės rizikos planinio stentavimo situacijos (suboptimali stento padėtis, kiti intervencijos aspektai, susiję su didele stento trombozės rizika, sudėtingu KVA kamieno arba daugybiniu stentavimu) arba jei dvigubas antitrombocitinis gydymas negali būti skiriamas dėl aspirino netoleravimo | IIb | C |
| Antitrombozinis gydymas pacientams po PVAI, sergantiems PV ar esant kitų indikacijų vartoti GAK | ||
| * Visa dozė TPGA (apiksabanas 5 mg 2 k./d., dabigatranas 150 mg 2 k./d., edoksabanas 60 mg 1 k./d. ar rivaroksabanas 20 mg 1 k./d.) rekomenduojama labiau negu VKA, skiriant kartu su antitrombocitiniais vaistais | I | A |
| * Rivaroksabano 15 mg 1 k./d. dozė (vietoj 20 mg 1 k./d.) turėtų būti svarstoma, kai yra didelė kraujavimo rizika, nusverianti stento trombozės ar išeminio insulto riziką | IIa | B |
| * Dabigatrano 110 mg 2 k./d. dozė (vietoj 150 mg 2 k./d.) turėtų būti svarstoma, kai yra didelė kraujavimo rizika, kuri nusveria stento trombozės ar išeminio insulto riziką | IIa | B |
| * Po nekomplikuotos PVAI turėtų būti svarstomas ankstyvas (<1 savaitę) aspirino nutraukimas ir dvigubos antitrombocitinės terapijos tęsimas su GAK bei klopidogreliu, kai kraujavimo rizika nusveria stento trombozės riziką, nepriklausomai nuo stento rūšies | IIa | B |
| * Turėtų būti apsvarstyta triguba terapija aspirinu, klopidogreliu ir GAK >1 mėnesį, kai stento trombozės rizika nusveria kraujavimo riziką. Numatoma terapijos trukmė yra iki 6 mėnesių. Tiksli trukmė turėtų būti nustatoma įvertinus riziką ir aiškiai nurodoma išrašant pacientą | IIa | C |
| * Pacientams, kuriems indikuotini VKA deriniai su aspirinu ir / ar klopidogreliu, VKA dozė turėtų būti titruojama taip, kad TNS būtų tiksliniame intervale 2,0–2,5 daugiau nei 70 proc. laiko | IIa | B |
| * Dviguba terapija (GAK, tikagreloru ar prasugreliu) galėtų būti svarstoma kaip alternatyva trigubai terapijai (GAK, aspirinu ir klopidogreliu) pacientams, kurie turi vidutinę ar didelę stento trombozės riziką nepriklausomai nuo stento rūšies | IIb | C |
| Tikagreloras arba prasugrelis nerekomenduojamas trigubai terapijai su aspirinu ir GAK | III | C |
| Kitas medikamentinis gydymas | ||
| * Rekomenduojama kartu skirti PSI pacientams, kurie gauna aspirino monoterapiją, dvigubą antitrombocitinę terapiją ar GAK monoterapiją, kai yra didelė kraujavimo iš žarnyno rizika | I | A |
| Statinai rekomenduojami visiems pacientams, sergantiems LKS | I | A |
| * Rekomenduojamas ezetimibas, jei lipidų tikslinė koncentracija nepasiekta skiriant maksimalią toleruojamą statino dozę | I | B |
| * Rekomenduojamas PCSK9 inhibitorius, jeigu lipidų tikslinė koncentracija nepasiekta vartojant maksimalią toleruojamą statino dozę ir ezetimibu | I | A |
| * Turėtų būti apsvarstoma AKFI skyrimas pacientams, sergantiems LKS, kai yra didelė KV įvykių rizika | IIa | A |
PAL – periferinių arterijų liga, PSIP – praeinantis smegenų išemijos priepuolis, PV – prieširdžių virpėjimas, TPGA – tiesioginio poveikio geriamieji antikoaguliantai, GAK – geriamieji antikoaguliantai, VKA – vitamino K antagonistai, PVAI – perkutaninė vainikinių arterijų intervencija, PSI – protonų siurblio inhibitoriai, AKFI – angiotenziną konvertuojančio fermento inhibitoriai.
* 2019 metų rekomendacijų naujienos.
4 pav. Indikacijų revaskuliarizacijai algoritmas
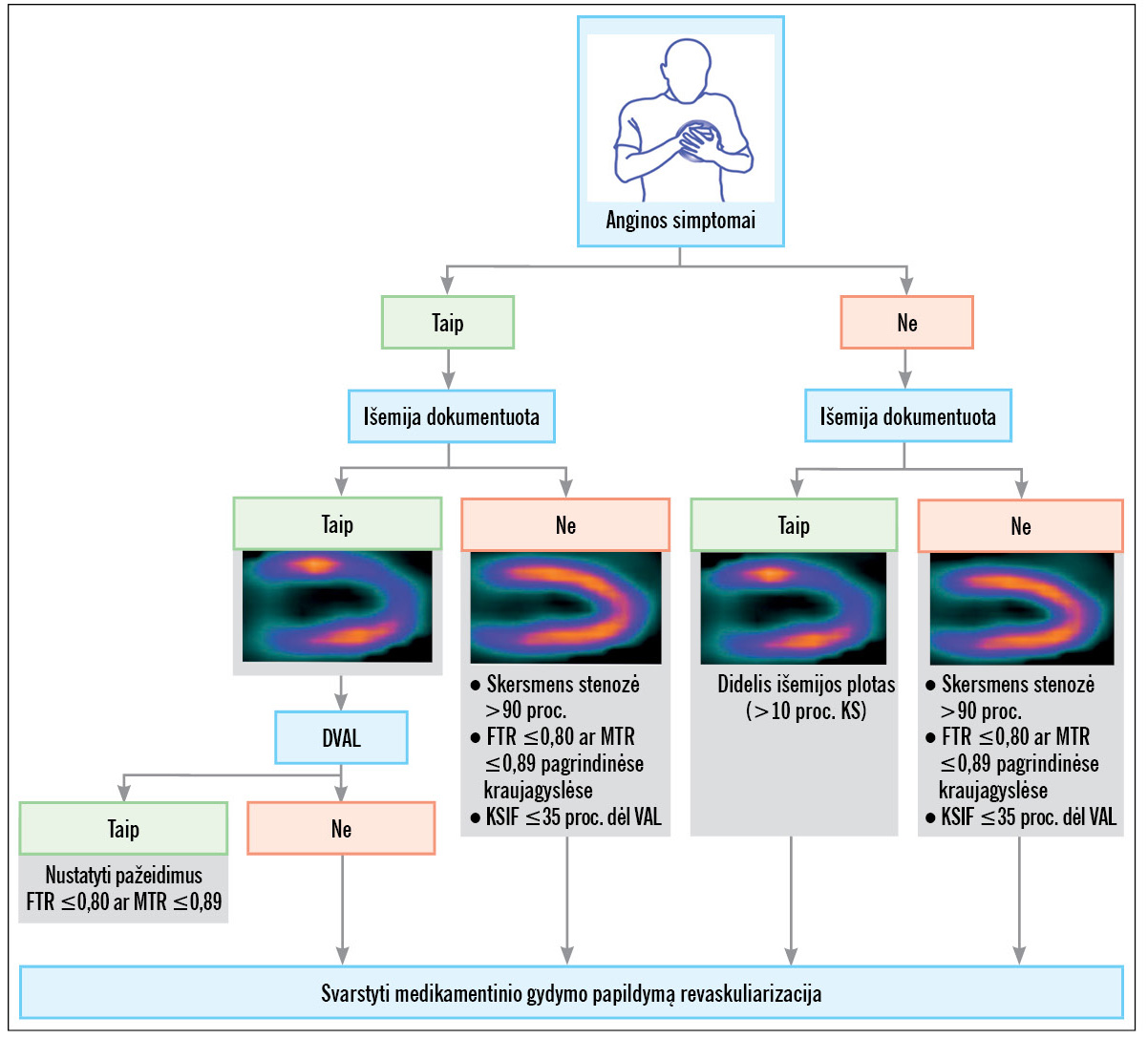
VAL – vainikinių arterijų liga, FTR – frakcinis tėkmės rezervas, MTR – momentinis tėkmės rezervas, KS – kairysis skilvelis,; KSIF – kairiojo skilvelio išstūmio frakcija, DVAL – dauginė vainikinių arterijų liga.
Revaskuliarizacija
Miokardo revaskuliarizacija yra svarbus LKS gydymo metodas, nes papildo medikamentinį gydymą. Jos tikslai yra sumažinti KA simptomus ir / ar pagerinti pacientų prognozę. Ankstesnėse gairėse revaskuliarizacija dažniausiai buvo indikuotina:
1) pacientams, kuriems, nepaisant optimalaus medikamentinio gydymo, išliko simptomatika;
2) siekiant pagerinti prognozę (43).
2019 metų atnaujintose gairėse revaskuliarizacija rekomenduojama kaip antros eilės gydymas po nesėkmingo medikamentinio gydymo pacientams, sergantiems KA ir ryškia stenoze. Remiantis simptomų buvimu ir neinvaziniais tyrimais, skirtais nustatyti išemiją, pasiūlytas algoritmas, kuris klinikinėje praktikoje leistų lengviau įvertinti indikacijas revaskuliarizacijai (4 pav.).
Tęsinys kitame žurnalo numeryje.
Leidinys "Internistas" Nr.8 2019 m.
LITERATŪRA
1. Juhani Knuuti, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes: The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC), European Heart Journal,
2. Reichlin T, et al. Early diagnosis of myocardial infarction with sensitive cardiac troponin assays. N Engl J Med 2009;361:858–867.
3. Keller T, et al. Sensitive troponin I assay in early diagnosis of acute myocardial infarction. N Engl J Med 2009;361:868–877.
4. da Silveira AD, et al. Association of anemia with clinical outcomes in stable coronary artery disease. Coron Artery Dis 2008;19:21–26.
5. Di Angelantonio E, Danesh J, Eiriksdottir G, Gudnason V. Renal function and risk of coronary heart disease in general populations: new prospective study and systematic review. PLoS Med 2007;4:e270.
6. Shlipak MG, Matsushita K, Arnlov J, Inker LA, Katz R, Polkinghorne KR, Rothenbacher D, Sarnak MJ, Astor BC, Coresh J, Levey AS, Gansevoort RT; Prognosis Consortium CKD. Cystatin C versus creatinine in determining risk based on kidney function. N Engl J Med 2013;369:932–943.
7. Silverman MG, Ference BA, Im K, Wiviott SD, Giugliano RP, Grundy SM, Braunwald E, Sabatine MS. Association between lowering LDL-C and cardiovascular risk reduction among different therapeutic interventions: a systematic review and meta-analysis. JAMA 2016;316:1289–1297.
8. Cholesterol Treatment Trialists’ (CTT) Collaboration, Fulcher J, O’Connell R, Voysey M, Emberson J, Blackwell L, Mihaylova B, Simes J, Collins R, Kirby A, Colhoun H, Braunwald E, La Rosa J, Pedersen TR, Tonkin A, Davis B, Sleight P, Franzosi MG, Baigent C, Keech A. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomised trials. Lancet 2015;385:1397–1405.
9. 2019 ESC/EASD Guidelines on diabetes, pre-diabetes, and cardiovascular diseases. Eur Hear J 2019:In press.
10. Bartnik M, Ryden L, Malmberg K, Ohrvik J, Pyorala K, Standl E, Ferrari R, Simoons M, Soler-Soler J; Euro Heart Survey Investigators. Oral glucose tolerance test is needed for appropriate classification of glucose regulation in patientswith coronary artery disease: a report from the Euro Heart Survey on Diabetes and the Heart. Heart 2007;93:72–77.
11. Daly C, Norrie J, Murdoch DL, Ford I, Dargie HJ, Fox K; TIBET (Total Ischaemic Burden European Trial) study group. The value of routine non-invasive tests to predict clinical outcome in stable angina. Eur Heart J 2003;24:532–540.
12. Daly CA, De Stavola B, Sendon JL, Tavazzi L, Boersma E, Clemens F, Danchin N, Delahaye F, Gitt A, Julian D, Mulcahy D, Ruzyllo W, Thygesen K, Verheugt F, Fox KM; Euro Heart Survey Investigators. Predicting prognosis in stable angina– results from the Euro heart survey of stable angina: prospective observational study. BMJ 2006;332:262–267.
13. Nagueh SF, Smiseth OA, Appleton CP, Byrd BF III, Dokainish H, Edvardsen T, Flachskampf FA, Gillebert TC, Klein AL, Lancellotti P, Marino P, Oh JK,Alexandru Popescu B, Waggoner AD. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from theAmerican Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2016;17:1321–1360.
14. Vitarelli A, Tiukinhoy S, Di Luzio S, Zampino M, Gheorghiade M. The role of echocardiography in the diagnosis and management of heart failure. Heart Fail Rev 2003;8:181–189.
15. Diamond GA, Forrester JS. Analysis of probability as an aid in the clinical diagnosis of coronary-artery disease. N Engl J Med 1979;300:1350–1358.
16. Reeh J, Therming CB, Heitmann M, Hojberg S, Sorum C, Bech J, Husum D, Dominguez H, Sehestedt T, Hermann T, Hansen KW, Simonsen L, Galatius S, Prescott E. Prediction of obstructive coronary artery disease and prognosis in patients with suspected stable angina. Eur Heart J 2018;40:1426–1435.
17. Foldyna B, Udelson JE, Karady J, Banerji D, Lu MT, Mayrhofer T, Bittner DO, Meyersohn NM, Emami H, Genders TSS, Fordyce CB, Ferencik M, Douglas PS, Hoffmann U. Pretest probability for patients with suspected obstructive coronary artery disease: re-evaluating Diamond-Forrester for the contemporary era and clinical implications: insights from the PROMISE trial. Eur Heart J Cardiovasc Imaging 2018;20:574–581.
18. Douglas PS, Hoffmann U, Patel MR, Mark DB, Al-Khalidi HR, Cavanaugh B, Cole J, Dolor RJ, Fordyce CB, Huang M, Khan MA, Kosinski AS, Krucoff MW, Malhotra V, Picard MH, Udelson JE, Velazquez EJ, Yow E, Cooper LS, Lee KL; PROMISE Investigators. Outcomes of anatomical versus functional testing for coronary artery disease. N Engl J Med 2015;372:1291–1300.
19. SCOT-HEART investigators. CT coronary angiography in patients with suspected angina due to coronary heart disease (SCOT-HEART): an open-label, parallelgroup, multicentre trial. Lancet 2015;385:2383–2391.
20. Greenwood JP, Ripley DP, Berry C, McCann GP, Plein S, Bucciarelli-Ducci C, Dall’Armellina E, Prasad A, Bijsterveld P, Foley JR, Mangion K, Sculpher M, Walker S, Everett CC, Cairns DA, Sharples LD, Brown JM; CE-MARC 2 Investigators. Effect of care guided by cardiovascular magnetic resonance, myocardial perfusion scintigraphy, or NICE guidelines on subsequent unnecessary angiography rates: the CE-MARC 2 randomized clinical trial. JAMA 2016;316:1051–1060.
21. Knuuti J, Ballo H, Juarez-Orozco LE, Saraste A, Kolh P, Rutjes AWS, Juni P, Windecker S, Bax JJ, Wijns W. The performance of non-invasive tests to rule-in and rule-out significant coronary artery stenosis in patients with stable angina: a meta-analysis focused on post-test disease probability. Eur Heart J 2018;39:3322–3330.
22. Lubbers M, Dedic A, Coenen A, Galema T, Akkerhuis J, Bruning T, Krenning B, Musters P, Ouhlous M, Liem A, Niezen A, Hunink M, de Feijter P, Nieman K. Calcium imaging and selective computed tomography angiography in comparison to functional testing for suspected coronary artery disease: the multicentre, randomized CRESCENT trial. Eur Heart J 2016;37:1232–1243.
23. Zacharias K, Ahmed A, Shah BN, Gurunathan S, Young G, Acosta D, Senior R. Relative clinical and economic impact of exercise echocardiography vs. exercise electrocardiography, as first line investigation in patients without known coronary artery disease and new stable angina: a randomized prospective study. Eur Heart J Cardiovasc Imaging 2017;18:195–202.
24. Williams MC, Hunter A, Shah ASV, Assi V, Lewis S, Smith J, Berry C, Boon NA, Clark E, Flather M, Forbes J, McLean S, Roditi G, van Beek EJR, Timmis AD, Newby DE; SCOT-HEART Investigators. Use of coronary computed tomographic angiography to guide management of patients with coronary disease. J Am Coll Cardiol 2016;67:1759–1768.
25. De Bruyne B, Pijls NH, Kalesan B, Barbato E, Tonino PA, Piroth Z, Jagic N, Mobius-Winkler S, Rioufol G, Witt N, Kala P, MacCarthy P, Engstrom T, Oldroyd KG, Mavromatis K, Manoharan G, Verlee P, Frobert O, Curzen N, Johnson JB, Juni P, Fearon WF; FAME 2 Trial Investigators. Fractional flow reserve-guided PCI versus medical therapy in stable coronary disease. N Engl J Med 2012;367:991–1001.
26. Tonino PA, De Bruyne B, Pijls NH, Siebert U, Ikeno F, van’ t Veer M, Klauss V, Manoharan G, Engstrom T, Oldroyd KG, Ver Lee PN, MacCarthy PA, Fearon WF; FAME Study Investigators. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention. N Engl J Med 2009;360:213–224.
27. Tonino PA, Fearon WF, De Bruyne B, Oldroyd KG, Leesar MA, Ver Lee PN, Maccarthy PA, Van’t Veer M, Pijls NH. Angiographic versus functional severity of coronary artery stenoses in the FAME study fractional flow reserve versus angiography in multivessel evaluation. J Am Coll Cardiol 2010;55:2816–2821.
28. Shaw LJ, Mieres JH, Hendel RH, Boden WE, Gulati M, Veledar E, Hachamovitch R, Arrighi JA, Merz CN, Gibbons RJ, Wenger NK, Heller GV; WOMEN Trial Investigators. Comparative effectiveness of exercise electrocardiography with or without myocardial perfusion single photon emission computed tomography in women with suspected coronary artery disease: results from the What Is the Optimal Method for Ischemia Evaluation in Women (WOMEN) trial. Circulation 2011;124:1239–1249.
29. Chow CK, Jolly S, Rao-Melacini P, Fox KA, Anand SS, Yusuf S. Association of diet, exercise, and smoking modification with risk of early cardiovascular events after acute coronary syndromes. Circulation 2010;121:750–758.
30. Booth JN III, Levitan EB, Brown TM, Farkouh ME, Safford MM, Muntner P. Effect of sustaining lifestyle modifications (nonsmoking, weight reduction, physical activity, and mediterranean diet) after healing of myocardial infarction, percutaneous intervention, or coronary bypass (from the REasons for Geographic and Racial Differences in Stroke Study). Am J Cardiol 2014;113:1933–1940.
31. Giannuzzi P, Temporelli PL, Marchioli R, Maggioni AP, Balestroni G, Ceci V, Chieffo C, Gattone M, Griffo R, Schweiger C, Tavazzi L, Urbinati S, Valagussa F, Vanuzzo D; GOSPEL Investigators. Global secondary prevention strategies to limit event recurrence after myocardial infarction: results of the GOSPEL study, a multicenter, randomized controlled trial from the Italian Cardiac Rehabilitation Network. Arch Intern Med 2008;168:2194–2204.
32. Keteyian SJ, Brawner CA, Savage PD, Ehrman JK, Schairer J, Divine G, Aldred H, Ophaug K, Ades PA. Peak aerobic capacity predicts prognosis in patients with coronary heart disease. Am Heart J 2008;156:292–300.
33. Camm AJ, Manolis A, Ambrosio G, Daly C, Komajda M, Lopez de Sa E, Lopez- Sendon JL, Mugelli A, Muggli F, Tamargo J. Unresolved issues in the management of chronic stable angina. Int J Cardiol 2015;201:200–207.
34. Ferrari R, Camici PG, Crea F, Danchin N, Fox K, Maggioni AP, Manolis AJ, Marzilli M, Rosano GMC, Lopez-Sendon JL. Expert consensus document: A ‘diamond’ approach to personalized treatment of angina. Nat Rev Cardiol 2018;15:120–132.
35. Ambrosio G, Mugelli A, Lopez-Sendon J, Tamargo J, Camm J. Management of stable angina: A commentary on the European Society of Cardiology guidelines. Eur J Prev Cardiol 2016;23:1401–1412.
36. Thadani U. Management of stable angina - current guidelines: a critical appraisal. Cardiovasc Drugs Ther 2016;30:419–426.
37. Husted SE, Ohman EM. Pharmacological and emerging therapies in the treatment of chronic angina. Lancet 2015;386:691–701.
38. National Institute for Health and Care Excellence (NICE). Stable angina: management. Clinical guideline [CG126]. https://www.nice.org.uk/guidance/cg126 (28 March 2019).
39. Klein WW, Jackson G, Tavazzi L. Efficacy of monotherapy compared with combined antianginal drugs in the treatment of chronic stable angina pectoris: a meta-analysis. Coron Artery Dis 2002;13:427–436.
40. Rousan TA, Mathew ST, Thadani U. Drug therapy for stable angina pectoris. Drugs 2017;77:265–284.
41. Pehrsson SK, Ringqvist I, Ekdahl S, Karlson BW, Ulvenstam G, Persson S. Monotherapy with amlodipine or atenolol versus their combination in stable angina pectoris. Clin Cardiol 2000;23:763–770.
42. Emanuelsson H, Egstrup K, Nikus K, Ellstrom J, Glud T, Pater C, Scheibel M, Tisell A, Totterman KJ, Forsby M. Antianginal efficacy of the combination of felodipine-metoprolol 10/100 mg compared with each drug alone in patients with stable effort-induced angina pectoris: a multicenter parallel group study. The TRAFFIC Study Group. Am Heart J 1999;137:854–862.
43. Neumann FJ, Sousa-Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U, Byrne RA, Collet JP, Falk V, Head SJ, Juni P, Kastrati A, Koller A, Kristensen SD, Niebauer J, Richter DJ, Seferovic PM, Sibbing D, Stefanini GG, Windecker S, Yadav R, Zembala MO. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2019;40:87–165.

