Reaktyvieji deguonies junginiai, aktyvios deguonies formos
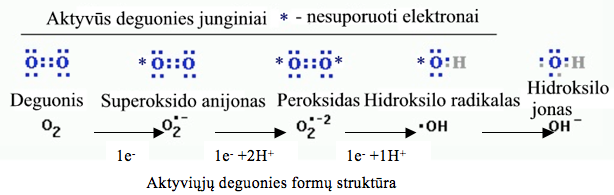
Deguonis ląstelėje tam tikrų sąlygų metu gali sukelti oksidacinius procesus, lemiančius įvairias ligas. Aterosklerozės, vėžio, artritų, taip pat organizmo senėjimo atvejais aktyvieji deguonies junginiai yra vienas iš svarbiausių pažeidžiančių veiksnių. Visose biologinės oksidacijos reakcijose elektronas nuo substrato yra perduodamas deguonies molekulei, dalyvaujant fermentams. Tam, kad deguonis redukuotųsi, t. y. susidarytų viena H2O molekulė, kiekvienas deguonies atomas turi prijungti po 2 elektronus arba deguonies molekulė – 4 elektronus: O2 + 4e– + 4H+ → 2H2O. Tačiau deguonies molekulės elektronų debesies struktūra yra palanki toksiškiems dalinės redukcijos produktams, kurie vadinami aktyviosiomis deguonies formomis. Deguonies elektronų debesies struktūra ypatinga tuo, kad deguonies atome yra du nesuporuoti elektronai, turintys vienos krypties sukinius. Toks deguonies atomas audinių ląstelėse turi prijungti iš substratų priešingų sukinių elektronų porą. Tam, kad deguonies atomas galėtų prijungti tokią elektronų porą ir sudaryti patvarią H2O molekulę, vieno iš prijungiamų elektronų sukinys turi pakeisti kryptį. Šis procesas yra daugiaetapis, jam reikia didelio aktyvumo energijos kiekio. Tai yra termodinamiškai nepalankus reiškinys. Todėl pirmiausiai prie O2 prijungiamas vienas elektronas, susidarant tarpiniam dalinės redukcijos produktui superoksido radikalui: O2 + e– → O2–• . Redukcija vyksta fermento aktyviajame centre, todėl superoksido radikalas čia lieka iki antrojo elektrono prijungimo. Reakcijos, dalyvaujant O2, ląstelėse dažniausiai vyksta oksidazių aktyviajame centre (deguonies molekulė yra dviejų elektronų ir dviejų protonų akceptorius) arba oksigenazių aktyviajame centre (oksiduojant deguonies molekulė tiesiog įsiterpia į substratą). Tokių fermentų pavyzdys yra mitochondrijų kvėpavimo grandinės citochromo oksidazė, katalizuojanti molekulinio deguonies redukciją iki H2O, suderintai pernešant 4 elektronus. Šios reakcijos metu sunaudojama apie 95 proc. mūsų įkvėpiamo deguonies. Tačiau dalis deguonies mitochondrijose gali būti redukuojama tik iš dalies, kai tarpinė redukcija įvyksta ne fermento aktyviąjame centre (pvz., esant O2 pertekliui). Tada susiformavęs superoksido radikalas sukelia grandinines reakcijas, dėl kurių susidaro aktyviosios deguonies formos: superoksido radikalas (O2•–), vandenilio peroksidas (H2O2) ir hidroksilo radikalas (OH·).
Aktyviosios deguonies formos, be minėtų, yra azoto oksido radikalas NO•, lipidų peroksidų radikalai LOO•, hipochlorito rūgštis HOCl, ozonas O3, taip pat singletinė deguonies molekulės forma (1O2).
Žmogaus organizme aktyviosios deguonies formos nuolat susidaro. Jų susidarymą gali skatinti vidiniai ir išoriniai veiksniai. Vidiniai veiksniai yra aktyvus mitochondrijų kvėpavimas, aktyvi ksantinoksidazė, reakcijos, kur dalyvauja geležis ir kiti pereinamieji metalai, arachidono rūgšties virsmų reakcijos, peroksidacija peroksisomose, taip pat kai kurios ligos ir uždegiminiai procesai. Iš išorinių veiksnių būtų galima paminėti rūkymą, didelės energijos ir ultravioletines spinduliuotes, ksenobiotikų ir ozono poveikį.
Superoksido radikalas (superoksido anijonas O2•–)
Superoksido radikalas (O2•–) susidaro, prijungiant vieną elektroną prie deguonies molekulės. Dažniausiai O2•– susidaro elektronų pernašos grandinėse – kvėpavimo ir mikrosominėje, nukrypus elektronams nuo grandinės tarpinių komponentų deguonies link. Fermentinė sistema, formuojanti O2•–, yra oksidazių kompleksas (NADPH, ksantino oksidazės, lipooksigenazė). Maži superoksido radikalų kiekiai nuolat susidaro mitochondrijų kvėpavimo grandinėje aerobinio metabolizmo metu. O2•– susidarymas svarbus, aktyvinant fagocitines ląsteles (neutrofilus, makrofagus, monocitus ir eozinofilus), tai lemia žmogaus organizmo gyvybinių funkcijų veiklą normaliai ir patologinių procesų metu. Superoksido radikalas yra oksidantas, jis gali oksiduoti įvairius junginius (pvz., adrenaliną, askorbo rūgštį), tačiau tuo pačiu turi neryškių redukcinių savybių. Superoksido radikalas reaguoja su baltymais, turinčiais prostetines pereinamųjų metalų grupes – hemus ar FeS sankaupas, todėl gali būti pažeista tokių baltymų biologinė funkcija (pvz., fermentų aktyvumas). Protonuojant (prisijungiant H+) iš O2•–, susidaro HO2•–, kuris yra stipresnis oksidatorius negu O2•– ir gali tiesiogiai reaguoti su linoleno ir arachido rūgštimis bei sudaryti hidroperoksidus. O2•– dalyvauja dismutacijos reakcijose, katalizuojamose superoksido dismutazės (SOD), susidarant vandenilio peroksidui:
O2•– + O2•– → O2 + H2O2
Vandenilio peroksidas H2O2. Žmogaus organizme H2O2 susidaro fagocituojančiose ląstelėse, mitochondrijose ir mikrosomose. Tai ne radikalas, tačiau aktyvus deguonies junginys, dalyvaujantis susidarant kitiems radikalams. H2O2 ląstelėje gali susidaryti iš superoksido radikalo minėtos dismutacijos reakcijos metu, taip pat reaguojant hidroksilo jonui ir hidroksilo radikalui su deguonimi:
OH– + HO• + O2 → H2O2 + O2•–
bei dviem elektronais redukuojant deguonį:
O2 + 2e– + 2H+→ H2O2
H2O2 yra stabilus deguonies redukcijos produktas. Šis junginys neturi krūvio, bet yra polinis, todėl laisvai keliauja vandeninėje aplinkoje. H2O2 pasižymi silpnomis oksidacinėmis savybėmis, pažeisdamas biologines molekules, turinčias -SH grupes ar FeS. Labiausiai H2O2 pažeidžiamas poveikis ryškėja, dalyvaujant pereinamųjų metalų jonams (Fe, Cu ir kt.). Jų metu susidaro dideliu aktyvumu pasižymintis hidroksilo radikalas ir hidroksilo jonas:
Fe2+ + H2O2 → Fe3+ + HO− + HO•.
Reakcija vadinama Fentono (Fenton) reakcija, nes jis nustatė, kad geležies druskos labai padidina H2O2 oksidacinį poveikį.
Hidroksilo radikalas OH·. Vienelektroninės H2O2 redukcijos metu susidaro hidroksilo radikalas, kuris pasižymi ypač dideliu reaktyvumu. H2O2 skilimas, dalyvaujant pereinamiesiems metalams, yra pagrindinis hidroksilo radikalų susidarymo būdas (Fentono reakcija). Šis radikalas nejudrus, nes iš karto (susidarymo vietoje) reaguoja su aplinkinėmis molekulėmis, jas pažeisdamas. Tai ypač stiprus oksidatorius. ·OH sąveikos su biomolekulėmis metu dažniausiai susidaro kitas, mažiau reaktyvus radikalas, kuris gali sklisti ir tęsti grandininę reakciją su kitomis molekulėmis. Tokio grandininio proceso pavyzdys gali būti nesočiųjų riebalų rūgščių peroksidinė oksidacija, kurią pradeda hidroksilo radikalas.
·OH radikalams būdingi trys pagrindiniai reakcijų tipai:
1. Vandenilio atomo atskėlimas nuo organinės molekulės, susidarant C radikalui:
- •OH + CH3CH2OH → H2O + •CH2−CH2OH.
2. Prisijungimas molekulės dvigubosios jungties C=C vietoje, susidarant OH grupei ir C radikalui:
- •OH + C6H6 → •C6H6OH.
3. Elektrono prijungimas iš kitų junginių, pvz., chloridų, nitritų:
•OH + Cl− → •Cl + HO−.
Hidroksilo radikalui sąveikaujant su DNR ir RNR struktūroje esančiomis bazėmis, pvz., su timinu, susidaro daug antrinių radikalų, galinčių pažeisti kitas azoto bazes ir monosacharidus bei nulemti nukleorūgščių grandinės trūkius. Tokios pažaidos gali būti mutacijų atsiradimo ir ląstelių žuvimo priežastis.
Azoto monooksidas (NO). Jungiantis vienam azoto atomui su vienu deguonies atomu, susidaro molekulė, turinti nesuporuotą elektronų porą, todėl NO yra laikomas radikalu. Azoto monooksidas yra sintetinamas NO sintazių įvairių audinių ląstelėse – makrofaguose, hepatocituose, astrocituose, endotelinėse ir lygiųjų raumenų ląstelėse. NO sintezė sužadinama (indukuojama), paveikus ląsteles citokinais, bakterijų toksinais. NO gyvavimas ląstelėje yra labai trumpas, tačiau ši molekulė dalyvauja reguliuojant tokius sudėtingus procesus kaip kraujagyslių tonuso palaikymas ar ilgalaikės atminties susidarymas. Be to, ji gina organizmą nuo mikrobų ir naikina vėžines ląsteles.
NO reaktyvumas yra toks pats, kaip ir molekulinio deguonies, todėl jis tiesiogiai neoksiduoja biomolekulių. Dabar yra pakankamai įrodymų, kad ląstelėje NO yra paverčiamas nitritu, o oksihemoglobinas ar oksimioglobinas nitritą lengvai oksiduoja iki nitrato. Taigi kraujyje galutinis NO metabolizmo produktas būtų nitratas: NO —-> NO2– —-> NO3–.
Dažniausiai NO toksiškumas yra siejamas su jo geba sudaryti peroksinitritą. Peroksinitritas susidaro reakcijų su superoksidu (O2–) metu: NO + O2– —-> ONOO–.
Šiai reakcijai nereikia jokio katalizatoriaus, taigi ir fermento, ji yra gana greita. Peroksinitritas yra stiprus oksidatorius, lengvai skylantis į hidroksilo radikalą (labai aktyvų ir destruktyvų radikalą) ir NO2:
ONOO– + H+ —-> ONOOH,
ONOOH —-> NO2 + HO..
Tokios reakcijos vyksta ląstelėje patologinių procesų metu. Yra žinoma, jog aktyvinti makrofagai, neutrofilai ir net endotelinių ląstelių kultūros išskiria peroksinitritą. Normaliai peroksinitrito koncentracija ląstelėse yra labai maža, nepaisant to, kad superoksido generacija yra gana didelė. Apie 1–5 proc. viso sunaudoto deguonies ląstelėse yra paverčiami superoksidu. Bet jį sėkmingai neutralizuoja superoksido dismutazė, kurios yra daug visose ląstelėse. Patologinėmis sąlygomis, kai vienu metu padidėja ir superoksido, ir NO generacija, peroksinitrito kiekis gali labai padidėti. Peroksinitritas gali tiesiogiai oksiduoti daugelį biologiškai svarbių molekulių, tokių kaip membranų lipidai, baltymai (-SH grupės ar tirozinas), Fe-S centrai, ląstelės antioksidantai (pvz., peroksinitritas paverčia vitaminą E į jo neaktyvią chinoninę formą). Peroksinitritas gali jungtis ir su baltymuose esančiu tirozinu. Be to, nitrotirozininti baltymai gali susidaryti superoksido dismutazės katalizuojamoje reakcijoje tarp NO ir superoksido. Tokių nitrotirozino junginių randama ląstelėse tam tikrų uždegiminių ligų atvejais, pvz., aterosklerozės pažeistose kraujagyslių sienelėse.
Šaltinis | Dažniausiai vartojamų biomedicinos terminų ir sąvokų aiškinamasis žinynas | Lietuvos sveikatos mokslų universitetas | Akademikas Profesorius Antanas Praškevičius, Profesorė Laima Ivanovienė

